
【题目】物质的量是高中化学常用的物理量,请完成以下有关计算。
(1)0.7 mol H2O的质量为___________。
(2)___________mol H2O2所含原子数与0.2 mol H3PO4所含原子数相等。
(3)某硫酸钠溶液中含有3.01×1022个Na+,则溶液中SO42-的物质的量是___________。
(4)a mol 氖气分子中所含电子数______________。(用NA表示)
(5)若某氯化钠溶液中,钠离子与水分子的物质的量之比为a : b,溶液的密度为d g/mL,则该氯化钠的物质的量浓度可表示为__________________。
【答案】12.6 g 0.4 0.025moL 10aNA ![]() mol/L
mol/L
【解析】
(1)0.7 mol H2O的质量为0.7×18=12.6 g。
(2) 0.2 mol H3PO4所含原子的物质的量为0.2×8=1.6mol,与之原子数相等的H2O2的物质的量为1.6/4=0.4mol。
(3)某硫酸钠溶液中含有3.01×1022个Na+,钠离子物质的量为0.05mol,则溶液中SO42-的物质的量是0.25mol。
(4)一个氖气分子有10个电子,所以a mol 氖气分子中所含电子数10aNA。
(5)若某氯化钠溶液中,钠离子与水分子的物质的量之比为a : b,溶液的密度为d g/mL,假设溶液的体积为1L,含有amol钠离子,则氯化钠的物质的量为amoll,溶液的体积为![]() mL,则该氯化钠的物质的量浓度可表示为
mL,则该氯化钠的物质的量浓度可表示为![]() mol/L。
mol/L。


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
【题目】已知氧化性: Cl2>Br2>Fe3+>I2,则下列离子方程式正确的是:
A. 少量氯气与FeBr2溶液反应Cl2+2Br-=2C1-+Br2
B. 过量氯气与FeBr2溶液反应Cl2+Fe2++2Br-=2Cl-+Br2+Fe3+
C. 氯气与FeBr2溶液以物质的量1:1反应2Cl2+2Fe2++2Br-=4Cl-+Br2+2Fe3+
D. 少量氯气与FeI2溶液反应Cl2+2Fe2+=2Cl-+2Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质的说法正确的是 ( )
A. C2H5OH(乙醇)是化合物,所以它是电解质
B. 固体Na2SO4不能导电,所以它是非电解质
C. 易溶性强电解质的溶液中不存在溶质分子
D. BaSO4难溶于水,所以BaSO4是弱电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FePO4是一种难溶于水、易溶于硫酸的固体,可用作金属防腐剂。实验室利用FeSO4.7H2O和H3PO4。(第一级电离常数Ka1=7.5×l0-3)制备FePO4流程如下:

(1)“溶解”时H3PO4不宜过量太多的原因是___。
(2)①写出“反应”时总反应的离子方程式:____。
②证明“反应”后铁元素沉淀完全的实验方法是___。
(3)①“过滤”所得产品呈棕黄色,则FePO4可能混有的杂质是____。
②洗涤FePO4沉淀的操作是 ___。
(4)FeSO4与(NH4)2SO4反应可制得摩尔盐[(NH4)2Fe (SO4)2.6H2O]。摩尔盐易溶于水.不溶于乙醇,性质比一般亚铁盐稳定,接近l00℃时易失去结晶水。相关物质的溶解度曲线如图所示。
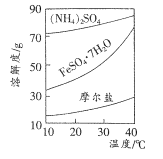
请补充完整由久置于空气中的FeSO4.7H2O样品合成摩尔盐的.实验步骤:将样品溶于适量的硫酸溶液中,加热使其溶解,然后向其中加入____。可选试剂:蒸馏水、饱和硫酸铵溶液、 3% H2O2、铜粉、铁粉、无水乙醇。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍、铂、镧等过渡金属单质及化合物在医疗领域有广泛的应用。
(1)基态原子镍的价电子排布式为_____。
(2)抗癌药奥沙利铂(又名乙二酸铂)的结构简式如图所示。
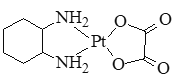
①分子中氮原子轨道的杂化类型是_____,C、N、O三种元素的第一电离能由大到小的顺序为_____。
②1 mol 乙二酸分子中含有σ键的数目为_____。
(3)碳酸镧[La2(CO3)3]用于治疗高磷血症。
①写出与CO![]() 互为等电子体的一种分子的化学式_____。
互为等电子体的一种分子的化学式_____。
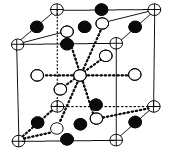
②镧镍合金可用于储氢,储氢后晶体的化学式为LaNi5(H2)3,其最小重复结构单元如图所示(![]() 、
、![]() 、
、![]() 代表晶体中的三种微粒),则图中
代表晶体中的三种微粒),则图中![]() 代表的微粒是_____。
代表的微粒是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钾和钠的化学性质相似,下列说法中能最好的解释这个事实的是( )
A.都是金属元素
B.原子半径相差不大
C.原子的最外层电子数相同
D.最高化合价相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见的食品脱氧剂多为无机铁系脱氧剂,其主要成分为活性铁粉。脱氧中的一步主要反应为:4Fe(OH)2 + O2 + 2H2O=4Fe(OH)3(红褐色固体)。
(1)Fe(OH)3中铁元素化合价为______,该脱氧反应中还原剂是_________。
(2)某化学兴趣小组用食品脱氧剂(2g铁粉、0.5g活性炭、0.5g氯化钠)进行如下两个实验。
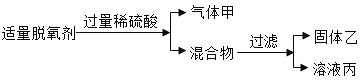
请回答:
①溶液丙中一定含有的金属阳离子是_________(写离子符号);
②检验溶液丙中Cl的方法是_____________________________________________。
将乙烘干后进行如下实验,物质之间的转化关系如图(部分产物略去)
③写出反应②的离子方程式,并用双线桥法表示电子转移的方向和数目_________;
④向溶液C中加入BaCl2溶液,有白色沉淀产生,其离子方程式为____________;反应③的化学方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.1mol/L氨水中滴加一定浓度的稀盐酸,溶液中水电离的氢离子浓度随加入盐酸体积的变化如右图所示。下列说法错误的是
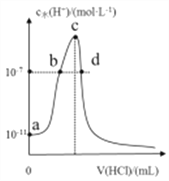
A. 常温下,0.1mol/L氨水的电离平衡常数Kb约为1.0×10-5
B. a、b之间的点一定满足:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
C. c点溶液中c(NH4+)-)
D. c点溶质为NH4Cl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com