
【题目】GaN是制造5G芯片的材料,氮化镓铝和氮化铝LED可发出紫外光。回答下列问题:
(1)基态As原子核外电子排布式为[Ar]___,下列状态的铝中,电离最外层的一个电子所需能量最小的是___(填标号)。
A.![]() B.
B.![]() C.[Ne] D.
C.[Ne] D.![]()
(2)8一羟基喹啉铝(分子式C27H18AlN3O3)用于发光材料及电子传输材料,可由LiAlH4与(8一羟基喹啉 )合成。LiAlH4中阴离子的空间构型为____;所含元素中电负性最大的是___(填元素符号),C、N、O的杂化方式依次为____、_____和____。
)合成。LiAlH4中阴离子的空间构型为____;所含元素中电负性最大的是___(填元素符号),C、N、O的杂化方式依次为____、_____和____。
(3)已知下列化合物的熔点:
化合物 | AlF3 | GaF3 | AlCl3 |
熔点/°C | 1040 | 1000 | 194 |
①表中卤化物的熔点产生差异的原因是_____。
②熔融AlCl3时可生成具有挥发性的二聚体Al2Cl6,二聚体Al2Cl6的结构式为____;其中Al的配位数为____。
(4)GaAs的晶胞结构如图所示,其晶胞参数为apm。

①紧邻的As原子之间的距离为x,紧邻的As、Ga原子之间的距离为y,则![]() __。
__。
②设阿伏加德罗常数的值为NA,则GaAs的密度是___g·cm一3(列出计算表达式)。
【答案】3d104s24p3 D 正四面体 O sp2 sp2 sp3 AlF3、GaF3为离子晶体,AlCl3为分子晶体,晶格能:AlF3>GaF3 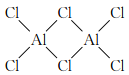 4
4 ![]()
![]()
【解析】
(1)As为33号元素,位于第四周期,依据核外电子排布规律写出基态As原子核外电子排布式;依据铝的第三电离能大于第二电离能,大于第一电离能;基态大于激发态,故D所需的能量最低。
(2)LiAlH4中阴离子为AlH4- ,n=(3+4+1)/2=4,Al无孤对电子,判断离子构型;8一羟基喹啉中环上的C、N、O的价层电子对去判断。
(3)依据物质组成及熔点等性质确定晶体类型。离子晶体熔点一般比分子晶体的高,离子晶体熔点由晶格能相对大小决定。
(4)根据晶胞的立体结构①紧邻的两个As原子的距离为![]() ,上述晶胞拆成8个等大的小立方体,4个的体心位置由Ga原子填充。小立方体的棱长为0.5a pm,则其体对角线长为
,上述晶胞拆成8个等大的小立方体,4个的体心位置由Ga原子填充。小立方体的棱长为0.5a pm,则其体对角线长为![]() ,则紧邻的As、Ga原子之间的距离
,则紧邻的As、Ga原子之间的距离![]() ,进而求出x/y。
,进而求出x/y。
②先求出:晶胞中含4个Ga、4个As,总质量为![]() ,再求出体积为(a×10-10)3cm3,由密度=m/V计算。
,再求出体积为(a×10-10)3cm3,由密度=m/V计算。
(1)As为33号元素,基态原子核外电子排布式为[Ar]3d104s24p3;依据铝的第三电离能大于第二电离能,大于第一电离能;基态大于激发态,故D所需的能量最低。
(2)LiAlH4中阴离子为AlH4-,n=(3+4+1)/2=4,Al无孤对电子,故为正四面体;8一羟基喹啉中环上的C、N均为sp2杂化,羟基氧为sp3杂化。
(3)依据物质组成及熔点可确定AlF3、GaF3为离子晶体,AlCl3为分子晶体。离子晶体熔点一般比分子晶体的高,离子晶体熔点由晶格能相对大小决定。
(4)①紧邻的两个As原子的距离为![]() ,上述晶胞拆成8个等大的小立方体,4个的体心位置由Ga原子填充。小立方体的棱长为0.5a pm,则其体对角线长为
,上述晶胞拆成8个等大的小立方体,4个的体心位置由Ga原子填充。小立方体的棱长为0.5a pm,则其体对角线长为![]() ,则紧邻的As、Ga原子之间的距离
,则紧邻的As、Ga原子之间的距离![]() ,
,![]() 。
。
②晶胞中含4个Ga、4个As,总质量为![]() ,体积为(a×10-10)3cm3,则密度为
,体积为(a×10-10)3cm3,则密度为![]() 。
。


科目:高中化学 来源: 题型:
【题目】A~G是前四周期除稀有气体之外原子序数依次增大的七种元素。A与其他元素既不同周期又不同族;B、C的价电子层中未成对电子数都是2;E核外的s、p能级的电子总数相等;F与E同周期且第一电离能比E小;G的+1价离子(G+)的各层电子全充满。回答下列问题:
(1)写出元素名称:B_______,G_______。
(2)写出F的价电子排布图:_______。
(3)写出化合物BC的结构式:__________________。
(4)由A、C、F三元素形成的离子[F(CA)4]— 是F在水溶液中的一种存在形式,其中F的杂化类型是________________。
(5)在测定A、D形成的化合物的相对分子质量时,实验测定值一般高于理论值的主要原因是______________________。
(6)E的一种晶体结构如图甲,则其一个晶胞中含有_______个E;G与D形成的化合物的晶胞结构如图乙,若晶体密度为ag/cm3,则G与D最近的距离为____pm
(阿伏加德罗常数用NA表示,列出计算表达式,不用化简;乙中○为G,●为D。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在可逆反应2A(g)+3B(g)![]() xC(g)+D(g)中,已知:起始浓度A为5mol/L,B为3mol/L,C的反应速率为0.5mol/(L·min),2min后,测得D的浓度为0.5mol/L。则关于此反应的下列说法中正确的是( )
xC(g)+D(g)中,已知:起始浓度A为5mol/L,B为3mol/L,C的反应速率为0.5mol/(L·min),2min后,测得D的浓度为0.5mol/L。则关于此反应的下列说法中正确的是( )
A.2min末时,A和B的浓度之比为5∶3B.x=1
C.2min末时,B的浓度为1.5mol/LD.2min末时,A的消耗浓度为0.5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)⑧的原子结构示意图为_________;
(2)②的气态氢化物分子的结构式为___________,②和⑦的气态氢化物的稳定性相比,其中较弱的是____ (用该氢化物的化学式表示);
(3)②、③的最高价含氧酸的酸性由强到弱的顺序是____(填化学式);
(4)⑤、⑥元素的金属性强弱依次为___________(填“增大”、“减小”或“不变”);
(5)④、⑤、⑥的形成的简单离子半径依次_________(填“增大”、“减小”或“不变”);
(6)①、④、⑤元素可形成既含离子键又含共价键的化合物,写出它的电子式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁过程中发生的反应:1/3Fe2O3(s)+CO(g)2/3Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下表,下列说法正确的是
温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
A. △H>0
B. 该反应的平衡常数表达式是![]()
C. 其他条件不变,向平衡体系充入CO2气体,K值减小
D. 其他条件不变,增大压强,平衡往逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M、N、X、Y四种主族元素在周期表里的相对位置如下图所示,已知它们的原子序数总和为46。
M | N | ||
X | Y |
(1)M与Y形成的化合物中含________键,属__________分子。(填“极性”或“非极性”)
(2)N元素形成的单质分子中的化学键类型及数目是__________________(填“σ键”或“π键”)。在化学反应中________易断裂。
(3)由N、Y的氢化物相互作用所生成的物质的电子式为____________________________。其中的化学键有__________________________。
(4)写出M单质与X元素最高价氧化物对应的水化物反应的化学方程式_______________________________________________________________________。
(5)核电荷数比X元素少8的元素可形成多种粒子,按要求填入空格中:
质子数 | 16 | 16 | 16 |
电子数 | 16 | 17 | 17 |
化学式 | ___________ | ________ | _________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同类晶体物质熔、沸点的变化是有规律的,试分析下列两组物质熔点规律性变化的原因:晶体熔、沸点的高低,决定于组成晶体微粒间的作用力的大小。A组是______晶体,晶体微粒之间通过________相连,粒子之间的作用力由大到小的顺序是________。B组晶体属于____________晶体,价电子数由少到多的顺序是__________,离子半径由大到小的顺序是__________。金属键强弱由小到大的顺序为______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。下列说法正确的是( )

A.2min时,v(X)=0.075molL-1min-1
B.2min时,v(X,正)=v(Y,逆)
C.上述反应在甲、乙不同条件下同时进行,分别测得甲:v(X)=9mol·L-1·min-1,乙:v(Y)=0.1mol·L-1·s-1,则甲反应更快。
D.Z为气态,若X、Y任意一种物质是非气态,则气体密度不变说明该反应达到化学平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子核外电子排布式为________________。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能Ⅰ1(Zn)_______Ⅰ1(Cu)(填“大于”或“小于”)。原因是________________。
(3)ZnF2具有较高的熔点(872 ℃),其化学键类型是_________;ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,原因是________________。
(4)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为________________,C原子的杂化形式为________________。
(5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为_______________。六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA,Zn的密度为________________g·cm-3(列出计算式)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com