
【题目】在可逆反应2A(g)+3B(g)![]() xC(g)+D(g)中,已知:起始浓度A为5mol/L,B为3mol/L,C的反应速率为0.5mol/(L·min),2min后,测得D的浓度为0.5mol/L。则关于此反应的下列说法中正确的是( )
xC(g)+D(g)中,已知:起始浓度A为5mol/L,B为3mol/L,C的反应速率为0.5mol/(L·min),2min后,测得D的浓度为0.5mol/L。则关于此反应的下列说法中正确的是( )
A.2min末时,A和B的浓度之比为5∶3B.x=1
C.2min末时,B的浓度为1.5mol/LD.2min末时,A的消耗浓度为0.5mol/L
 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
【题目】有关下列图象的说法正确的是( )
A. 表示的反应速率随温度变化的关系可知该反应的△H>0

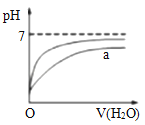
B. 表示向pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,则其中曲线a对应的是醋酸
C. 表示该反应为放热反应,且催化剂能降低反应的活化能、改变反应的焓变

D. 中开关K置于a或b处均可减缓铁的腐蚀

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A. ![]() =1×10-12的溶液:Na+、K+、ClO-、CO32-
=1×10-12的溶液:Na+、K+、ClO-、CO32-
B. 滴入酚酞变红色的溶液:K+、Ca2+、HCO3-、CO32-
C. 能溶解Al(OH)3的溶液:K+、NH4+、NO3—、CH3COO—
D. 0.1mol/LFe(NO3)2溶液:H+、Cu2+、SO42—、Cl—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在用氨气饱和的食盐水中通入足量二氧化碳可生成NaHCO3固体,反应原理如下: NH3+CO2+H2O=NH4HCO3 NH4HCO3+NaCl=NaHCO3↓+NH4Cl,化学兴趣小组同学根据该原理和如下装置在实验室制备NaHCO3。

实验步骤如下:
Ⅰ、连接好如图装置,检查气密性后,在仪器内装入相应药品。
Ⅱ、在丙装置制备氨气,并通入到丁中饱和食盐水中,直至不再溶解时,然后在饱和食盐水中通入二氧化碳气体,片刻后,丁装置广口瓶中出现固体。继续向广口瓶中通入两种气体,直到不再有固体产生。
Ⅲ、过滤丁中广口瓶中所得的混合物,洗涤、干燥,得到NaHCO3固体。
(1)盛装盐酸的仪器名称是_____________。
(2)乙中溶液是_______(填字母代号)。
A.浓硫酸 B.饱和Na2CO3溶液 C.饱和NaHCO3溶液
(3)装置的部分连接顺序是:a接________(填“c”或“d”);丁装置中球形干燥管的作用是_________________________________。
(4)请解释在实验步骤Ⅱ中,先通入氨气的理由是________________________________________。
(5)取m g NaHCO3样品(杂质只含有少量NaCl)溶于足量盐酸,蒸干后称得固体质量为n g,则样品中NaHCO3的质量分数为_____________(用含m、n的代数式表示,不用化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子交换法淡化海水的实验装置如图所示,下列说法正确的是

A. 通过HR树脂后,溶液中的离子数目和溶液的导电能力不变
B. HR树脂与ZOH树脂的位置可交换
C. 通过HR树脂时,溶液中有离子反应H++OH-═H2O发生
D. 工作一段时间后,两种树脂均需进行再生处理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用原电池原理,在室温下从含低浓度铜的酸性废水中回收铜的实验装置如图所示,下列说法错误的是

A. X、Y依次为阳离子、阴离子选择性交换膜
B. 负极的电极反应式:BH4-+8OH-一8e-═B(OH)4-+4H2O
C. 2室流出的溶液中溶质为Na2SO4和K2SO4
D. 电路中每转移1mol电子,电极2上有32gCu析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量![]() N2和水蒸气,并放出大量热.已知0.4mol液态肼和足量液态H2O2反应,生成氮气和水蒸气,放出256kJ的热量.
N2和水蒸气,并放出大量热.已知0.4mol液态肼和足量液态H2O2反应,生成氮气和水蒸气,放出256kJ的热量.
(1)写出该反应的热化学方程式_______________________________________.
(2)已知H2O(l)═H2O(g);△H=+44kJ·mol﹣1,则16g液态肼燃烧生成氮气和液态水时,放出的热量是________kJ.
(3)丙烷燃烧可以通过以下两种途径:
途径I:C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=﹣a kJ·mol﹣1
途径II:C3H8(g)═C3H6(g)+H2(g)△H=+b kJ·mol﹣1
2C3H6(g)+9O2(g)═6CO2(g)+6H2O(l)△H=﹣c kJ·mol﹣1
2H2(g)+O2 (g)═2H2O(l)△H=﹣d kJ·mol﹣1 (abcd均为正值)
请回答下列问题:
①判断等量的丙烷通过两种途径放出的热量,途径I放出的热量_______(填“大于”、“等于”或“小于”)途径II放出的热量.
②在C3H8(g)═C3H6(g)+H2(g) 的反应中,反应物具有的总能量________(填“大于”、“等于”或“小于”)生成物具有的总能量.
③b 与a、c、d的数学关系式是_____________.
II、利用如图所示装置测定中和热的实验步骤如下:

①用量筒量取50 mL 0.50 mol·L1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50 mL 0.55 mol·L1 NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。
回答下列问题:
(1)为什么所用NaOH溶液要稍过量?__________________________。
(2)假设盐酸和氢氧化钠溶液的密度都是1 g·cm3,又知中和反应后生成溶液的比热容c=4.18 J·g1·℃1。为了计算中和热,某学生实验记录数据如下:
实验 序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | 氢氧化钠 | ||
1 | 20.0 | 20.0 | 23.0 |
2 | 20.1 | 20.1 | 23.2 |
3 | 20.2 | 20.2 | 23.4 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=________kJ·mol1_(结果保留一位小数)。
(3)不能用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】GaN是制造5G芯片的材料,氮化镓铝和氮化铝LED可发出紫外光。回答下列问题:
(1)基态As原子核外电子排布式为[Ar]___,下列状态的铝中,电离最外层的一个电子所需能量最小的是___(填标号)。
A.![]() B.
B.![]() C.[Ne] D.
C.[Ne] D.![]()
(2)8一羟基喹啉铝(分子式C27H18AlN3O3)用于发光材料及电子传输材料,可由LiAlH4与(8一羟基喹啉 )合成。LiAlH4中阴离子的空间构型为____;所含元素中电负性最大的是___(填元素符号),C、N、O的杂化方式依次为____、_____和____。
)合成。LiAlH4中阴离子的空间构型为____;所含元素中电负性最大的是___(填元素符号),C、N、O的杂化方式依次为____、_____和____。
(3)已知下列化合物的熔点:
化合物 | AlF3 | GaF3 | AlCl3 |
熔点/°C | 1040 | 1000 | 194 |
①表中卤化物的熔点产生差异的原因是_____。
②熔融AlCl3时可生成具有挥发性的二聚体Al2Cl6,二聚体Al2Cl6的结构式为____;其中Al的配位数为____。
(4)GaAs的晶胞结构如图所示,其晶胞参数为apm。

①紧邻的As原子之间的距离为x,紧邻的As、Ga原子之间的距离为y,则![]() __。
__。
②设阿伏加德罗常数的值为NA,则GaAs的密度是___g·cm一3(列出计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁一空气电池的工作原理如图所示,电池反应方程式为:2Mg+O2+2H2O=2Mg(OH)2。有关该电池的说法正确的是( )

A. 通入氧气的电极为负极
B. 电池工作时,溶液中的Na+由负极移向正极
C. 负极的电极反应为Mg-2e-+2OH-=Mg(OH)2
D. 当电路中转移0.04 mol电子时,参加反应的O2为体积224ml
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com