
【题目】在用氨气饱和的食盐水中通入足量二氧化碳可生成NaHCO3固体,反应原理如下: NH3+CO2+H2O=NH4HCO3 NH4HCO3+NaCl=NaHCO3↓+NH4Cl,化学兴趣小组同学根据该原理和如下装置在实验室制备NaHCO3。

实验步骤如下:
Ⅰ、连接好如图装置,检查气密性后,在仪器内装入相应药品。
Ⅱ、在丙装置制备氨气,并通入到丁中饱和食盐水中,直至不再溶解时,然后在饱和食盐水中通入二氧化碳气体,片刻后,丁装置广口瓶中出现固体。继续向广口瓶中通入两种气体,直到不再有固体产生。
Ⅲ、过滤丁中广口瓶中所得的混合物,洗涤、干燥,得到NaHCO3固体。
(1)盛装盐酸的仪器名称是_____________。
(2)乙中溶液是_______(填字母代号)。
A.浓硫酸 B.饱和Na2CO3溶液 C.饱和NaHCO3溶液
(3)装置的部分连接顺序是:a接________(填“c”或“d”);丁装置中球形干燥管的作用是_________________________________。
(4)请解释在实验步骤Ⅱ中,先通入氨气的理由是________________________________________。
(5)取m g NaHCO3样品(杂质只含有少量NaCl)溶于足量盐酸,蒸干后称得固体质量为n g,则样品中NaHCO3的质量分数为_____________(用含m、n的代数式表示,不用化简)。
【答案】分液漏斗 C d 防止倒吸 在相同条件下,氨气在水中的溶解度远大于二氧化碳,在饱和食盐水中先通入氨气,形成浓的食盐氨水混合溶液,能与更多的二氧化碳反应,进而提高NaHCO3的产量 ![]()
【解析】
“侯氏制碱法”的实验原理是:CO2+NH3+H2O+NaCl=NaHCO3↓+NH4Cl,即制碱过程中所需的两种气体是CO2和NH3,实验室用块状石灰石和稀盐酸反应产生CO2,用浓氨水和CaO或NH4Cl和碱石灰混合制NH3。NH3极易溶于水,而CO2在水中的溶解度不大,为使CO2能更多地溶于水与NaCl反应,可先使NH3溶于水达饱和,使溶液呈碱性,这会使酸性氧化物更多地被溶解吸收。因NH3极易溶于水,故要考虑到NH3的倒吸问题。设计实验证明固体大部分是NH4Cl时,首先应想到NH4Cl的性质:加热易分解,冷却又化合,故可围绕此性质来设计实验。
(1)根据仪器的构造可知,盛装盐酸的仪器名称是分液漏斗;
(2)盐酸易挥发,制取的二氧化碳中含有氯化氢气体,必须通过饱和NaHCO3溶液除去氯化氢,则乙中溶液是饱和NaHCO3溶液;
答案选C;
(3)足量的CO2与NaOH反应生成NaHCO3,装置A产生CO2,装置B产生NH3,装置D除去二氧化碳中的HCl,二氧化碳与氨气通入C中应防止倒吸,则b接d,故a接c;
(4) 先通入氨气,氨气与水形成呈碱性的氨水可与二氧化碳与水生成的碳酸发生反应,更有利于二氧化碳气体的吸收,故应先发生氨气的制备反应;
(5)取m g NaHCO3样品(杂质只含有少量NaCl)溶于足量盐酸,蒸干后称得固体质量为n g,根据反应方程式NaHCO3+HCl= NaCl +CO2 ↑+H2O,设NaHCO3的质量为x,利用差量法可知:
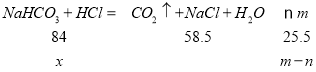
![]() ,则样品中NaHCO3的质量分数为
,则样品中NaHCO3的质量分数为![]() 。
。


科目:高中化学 来源: 题型:
【题目】对于下列实验现象的解释,不合理的是
实验 | 现象 | 解释 | |
A | | ②中产生气体的速率比①慢 | 乙醇分子中,乙基对羟基产生影响,使O—H键不容易断裂 |
B |
| ③中振荡静置后分层,上层为橙色;④中产生白色沉淀 | 苯酚分子中,苯环对羟基产生影响,使O—H键更容易被取代 |
C |
| ⑤中振荡静置后分层,下层为紫色溶液;⑥中振荡后紫色溶液褪色 | 甲苯分子中,苯环对甲基产生影响,使甲基上C—H更容易被氧化 |
D |
| 水浴加热,⑦中未见明显变化;⑧中试管壁上附着一层光亮的银 | 碱性条件下+1价的Ag才能氧化乙醛 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G是前四周期除稀有气体之外原子序数依次增大的七种元素。A与其他元素既不同周期又不同族;B、C的价电子层中未成对电子数都是2;E核外的s、p能级的电子总数相等;F与E同周期且第一电离能比E小;G的+1价离子(G+)的各层电子全充满。回答下列问题:
(1)写出元素名称:B_______,G_______。
(2)写出F的价电子排布图:_______。
(3)写出化合物BC的结构式:__________________。
(4)由A、C、F三元素形成的离子[F(CA)4]— 是F在水溶液中的一种存在形式,其中F的杂化类型是________________。
(5)在测定A、D形成的化合物的相对分子质量时,实验测定值一般高于理论值的主要原因是______________________。
(6)E的一种晶体结构如图甲,则其一个晶胞中含有_______个E;G与D形成的化合物的晶胞结构如图乙,若晶体密度为ag/cm3,则G与D最近的距离为____pm
(阿伏加德罗常数用NA表示,列出计算表达式,不用化简;乙中○为G,●为D。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备铝一般是从铝土矿(主要成分是Al2O3,含有Fe2O3杂质)中得到纯净的Al2O3,然后电解Al2O3得到铝。下图是从铝土矿中提纯Al2O3的简单示意图。其中涉及到的一个反应:2NaAlO2+CO2+3H2O=Na2CO3+2Al(OH)3↓。

(1)图示中实验操作(1)是________;加入的试剂②是__________(填化学式)
(2)试写出B溶液中的溶质的化学式:_____________
(3)写出化学方程式:
①铝土矿→A:_________________________________________________。
②E→F:_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色稀溶液X中,可能含有下表所列离子中的某几种。
阴离子 | CO32-、SiO32-、AlO2-、Cl- |
阳离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系如图所示。

(1)若Y是盐酸,则oa段转化为沉淀的离子(指来源于X溶液的,下同)是________________________,ab段发生反应的离子是________,bc段发生反应的离子方程式为___________________________________。
(2)若Y是NaOH溶液,则X中一定含有的阳离子是____________________, ab段反应的离子方程式为_______________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA为阿伏加德罗常数的值,下列说法正确的是
A. 3gCO2中含有的质子数为1.5NA
B. 1L0.1mol·L-1 Na2SiO3溶液中含有的SiO32-数目为0.1NA
C. 0.1molH2O2分解产生O2时,转移的电子数为0.2NA
D. 2.8g聚乙烯中含有的碳碳双键数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在可逆反应2A(g)+3B(g)![]() xC(g)+D(g)中,已知:起始浓度A为5mol/L,B为3mol/L,C的反应速率为0.5mol/(L·min),2min后,测得D的浓度为0.5mol/L。则关于此反应的下列说法中正确的是( )
xC(g)+D(g)中,已知:起始浓度A为5mol/L,B为3mol/L,C的反应速率为0.5mol/(L·min),2min后,测得D的浓度为0.5mol/L。则关于此反应的下列说法中正确的是( )
A.2min末时,A和B的浓度之比为5∶3B.x=1
C.2min末时,B的浓度为1.5mol/LD.2min末时,A的消耗浓度为0.5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)⑧的原子结构示意图为_________;
(2)②的气态氢化物分子的结构式为___________,②和⑦的气态氢化物的稳定性相比,其中较弱的是____ (用该氢化物的化学式表示);
(3)②、③的最高价含氧酸的酸性由强到弱的顺序是____(填化学式);
(4)⑤、⑥元素的金属性强弱依次为___________(填“增大”、“减小”或“不变”);
(5)④、⑤、⑥的形成的简单离子半径依次_________(填“增大”、“减小”或“不变”);
(6)①、④、⑤元素可形成既含离子键又含共价键的化合物,写出它的电子式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。下列说法正确的是( )

A.2min时,v(X)=0.075molL-1min-1
B.2min时,v(X,正)=v(Y,逆)
C.上述反应在甲、乙不同条件下同时进行,分别测得甲:v(X)=9mol·L-1·min-1,乙:v(Y)=0.1mol·L-1·s-1,则甲反应更快。
D.Z为气态,若X、Y任意一种物质是非气态,则气体密度不变说明该反应达到化学平衡状态
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com