
����Ŀ��ij��ɫϡ��ҺX�У����ܺ����±����������е�ij���֡�
������ | CO32-��SiO32-��AlO2-��Cl�� |
������ | Al3����Fe3����Mg2����NH4+��Na�� |
��ȡ����Һ�����������м���ij�Լ�Y���������������ʵ���(n)������Լ����(V)�Ĺ�ϵ��ͼ��ʾ��

(1)��Y�����ᣬ��oa��ת��Ϊ����������(ָ��Դ��X��Һ�ģ���ͬ)��________________________��ab�η�����Ӧ��������________��bc�η�����Ӧ�����ӷ���ʽΪ___________________________________��
(2)��Y��NaOH��Һ����X��һ�����е���������____________________�� ab�η�Ӧ�����ӷ���ʽΪ_______________________________________________________________________��
���𰸡�SiO32-��AlO2 CO32- Al(OH)3��3H��=Al3����3H2O Al3����Mg2����NH4+ NH4+��OH��=NH3��H2O
��������
��Һ��ɫ˵����Һ�в���Fe3�����ӣ�
��1����Y�����ᣬoa�β����ij�������ΪAl(OH)3��H2SiO3��ab�ε��ص�Ϊ�������ᣬ�����������䣬ȷ����CO32����
��2����YΪNaOH�����ݳ������ı仯ȷ��һ������Al3+��Mg2+��NH4+��
��Һ��ɫ˵����Һ�в���Fe3�����ӣ�
��1����Y�����ᣬoa�β����ij�������ΪAl(OH)3��H2SiO3��ab�ε��ص�Ϊ�������ᣬ�����������䣬ȷ����CO32����bc�γ���������Һ��ȷ��ΪAl(OH)3��H2SiO3������oa��ת��Ϊ������������AlO2-��SiO32-��ab�η�����Ӧ��������CO32����2H��=H2O��CO2����������Ӧ��������CO32-��bc�η�����Ӧ�����ӷ���ʽΪAl(OH)3+3H+=Al3++3H2O��
��2����YΪNaOH�����ݳ������ı仯ȷ��һ������Al3+��Mg2+��NH4+�����ͼ��bc�η�����Ӧ:Al(OH)3��OH��=AlO2����2H2O��oa�η�����Ӧ��Al3����3OH��=Al(OH)3����Mg2����2OH��=Mg(OH)2����ab�η�����ӦNH4++OH-=NH3��H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����к�Fe(NO3)3��Cu(NO3)2��HNO3��ijϡ��Һ�����������������ۣ���Һ��Fe2+Ũ����������۵����ʵ���֮��Ĺ�ϵ����ͼ��ʾ�������Һ��Fe(NO3)3��Cu(NO3)2��HNO3���ʵ���Ũ��֮��Ϊ( )

A. 1��1��3B. 1��2��4C. 1��1��4D. 1��3��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£�����CO2�ϳ�CH3OH�ķ�Ӧ���£� CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ��H1���о����֣���Ӧ�����л��и���Ӧ��CO2(g)+H2(g)
CH3OH(g)+H2O(g) ��H1���о����֣���Ӧ�����л��и���Ӧ��CO2(g)+H2(g)![]() CO(g)+H2O(g) ��H2���¶ȶ�CH3OH��CO�IJ���Ӱ����ͼ��ʾ������˵���У�����ȷ����( )
CO(g)+H2O(g) ��H2���¶ȶ�CH3OH��CO�IJ���Ӱ����ͼ��ʾ������˵���У�����ȷ����( )

A. ��H1��0����H2��0
B. ����ѹǿ�����ڼӿ�ϳɷ�Ӧ������
C. ���������У��¶�Խ��Խ���������CH3OH�IJ���
D. �ϳ�CH3OH��Ӧ��ƽ�ⳣ������ʽ��K=![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£����и���������ָ����Һ���ܴ����������
A. ![]() =1��10-12����Һ��Na+��K+��ClO-��CO32-
=1��10-12����Һ��Na+��K+��ClO-��CO32-
B. �����̪���ɫ����Һ��K+��Ca2+��HCO3-��CO32-
C. ���ܽ�Al��OH��3����Һ��K+��NH4+��NO3����CH3COO��
D. 0.1mol/LFe(NO3)2��Һ��H+��Cu2+��SO42����Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڵؿ�����Ҫ��NaIO3����ʽ���ڣ��ں�ˮ����Ҫ��I-����ʽ���ڣ�������֮���ת����ϵ��ͼ��ʾ����֪�����������ʵ����������˵���У�����ȷ����
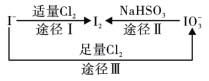
A. �����Ե�ǿ��˳��Ϊ��Cl2 >IO3- >I2
B. һ�������£� I-��IO3-��Ӧ��������I2
C. ;������������1mol I2������4mol NaHSO3
D. ��I-����Һ��ͨ��Cl2��������Һ���������Һ��һ����Ϊ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ð������͵�ʳ��ˮ��ͨ������������̼������NaHCO3���壬��Ӧԭ�����£� NH3��CO2��H2O��NH4HCO3 NH4HCO3��NaCl��NaHCO3����NH4Cl����ѧ��ȤС��ͬѧ���ݸ�ԭ��������װ����ʵ�����Ʊ�NaHCO3��

ʵ�鲽�����£�
�����Ӻ���ͼװ�ã���������Ժ���������װ����ӦҩƷ��
���ڱ�װ���Ʊ���������ͨ�뵽���б���ʳ��ˮ�У�ֱ�������ܽ�ʱ��Ȼ���ڱ���ʳ��ˮ��ͨ�������̼���壬Ƭ�̺�װ�ù��ƿ�г��ֹ��塣��������ƿ��ͨ���������壬ֱ�������й��������
���˶��й��ƿ�����õĻ���ϴ�ӡ�����õ�NaHCO3���塣
(1)ʢװ���������������_____________��
(2)������Һ��_______������ĸ���ţ���
A��Ũ���� B������Na2CO3��Һ C������NaHCO3��Һ
(3)װ�õIJ�������˳���ǣ�a��________���c����d��������װ�������θ���ܵ�������_________________________________��
(4)�������ʵ�鲽����У���ͨ�백����������________________________________________��
(5)ȡm g NaHCO3��Ʒ������ֻ��������NaCl�������������ᣬ���ɺ�Ƶù�������Ϊn g������Ʒ��NaHCO3����������Ϊ_____________���ú�m��n�Ĵ���ʽ��ʾ�����û���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ӽ�����������ˮ��ʵ��װ����ͼ��ʾ������˵����ȷ����

A. ͨ��HR��֬����Һ�е�������Ŀ����Һ�ĵ�����������
B. HR��֬��ZOH��֬��λ�ÿɽ���
C. ͨ��HR��֬ʱ����Һ�������ӷ�ӦH����OH-�TH2O����
D. ����һ��ʱ���������֬���������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I���ڻ���ƽ�����װ��ǿ��ԭ���£�N2H4����ǿ��������H2O2���������ǻ��ʱ������������![]() N2��ˮ���������ų������ȣ���֪0.4molҺ̬�º�����Һ̬H2O2��Ӧ�����ɵ�����ˮ�������ų�256kJ��������
N2��ˮ���������ų������ȣ���֪0.4molҺ̬�º�����Һ̬H2O2��Ӧ�����ɵ�����ˮ�������ų�256kJ��������
��1��д���÷�Ӧ���Ȼ�ѧ����ʽ_______________________________________��
��2����֪H2O��l���TH2O��g������H=+44kJ��mol��1����16gҺ̬��ȼ�����ɵ�����Һ̬ˮʱ���ų���������________kJ��
��3������ȼ�տ���ͨ����������;����
;��I��C3H8��g��+5O2��g���T3CO2��g��+4H2O��l����H=��a kJ��mol��1
;��II��C3H8��g���TC3H6��g��+H2��g����H=+b kJ��mol��1
2C3H6��g��+9O2��g���T6CO2��g��+6H2O��l����H=��c kJ��mol��1
2H2��g��+O2 ��g���T2H2O��l����H=��d kJ��mol��1 ��abcd��Ϊ��ֵ��
��ش��������⣺
���жϵ����ı���ͨ������;���ų���������;��I�ų�������_______��������������������������С������;��II�ų���������
����C3H8��g���TC3H6��g��+H2��g�� �ķ�Ӧ�У���Ӧ����е�������________��������������������������С��������������е���������
��b ��a��c��d����ѧ��ϵʽ��_____________��
II��������ͼ��ʾװ�òⶨ�к��ȵ�ʵ�鲽�����£�

������Ͳ��ȡ50 mL 0.50 mol��L1���ᵹ��С�ձ��У���������¶ȣ�������һ��Ͳ��ȡ50 mL 0.55 mol��L1 NaOH��Һ������ͬһ�¶ȼƲ�����¶ȣ��۽�NaOH��Һ����С�ձ��У��跨ʹ֮��Ͼ��ȣ���û��Һ����¶ȡ�
�ش��������⣺
��1��Ϊʲô����NaOH��ҺҪ�Թ�����__________________________��
��2���������������������Һ���ܶȶ���1 g��cm3����֪�кͷ�Ӧ��������Һ�ı�����c��4.18 J��g1����1��Ϊ�˼����к��ȣ�ijѧ��ʵ���¼�������£�
ʵ�� ��� | ��ʼ�¶�t1/�� | ��ֹ�¶�t2/�� | |
���� | �������� | ||
1 | 20.0 | 20.0 | 23.0 |
2 | 20.1 | 20.1 | 23.2 |
3 | 20.2 | 20.2 | 23.4 |
���ݸ�ѧ����ʵ�����ݼ��㣬��ʵ���õ��к�����H��________kJ��mol1_(�������һλС��)��
��3��������Ba(OH)2��Һ�������������������Һ�����ᣬ������_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�ֽ�1mol KClO3�ų�����38.8kJ���ڴ���MnO2�����¼���,KClO3�ķֽ����Ϊ��
��2KClO3+4MnO2=2KCl+2Mn2O7 �� ��2Mn2O7=4MnO2+3O2 ��
�����й�˵���в���ȷ����( )
A. 1mol KClO3���������������1mol KCl��1.5mol O2�����������
B. KClO3�ֽ����ʿ�����Ҫȡ���ڷ�Ӧ��
C. 1g KClO3��1g MnO2��0.1g Mn2O7��ϼ��ȣ���ַ�Ӧ��MnO2����Ϊ1g
D. �����������������,�ɼӿ�KClO3�ķֽ�����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com