
【题目】若往20 mL 0.01 mol·L-1 HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示。下列有关说法不正确的是

A. HNO2的电离平衡常数:c点>b点
B. b点混合溶液显酸性:c(Na+)>c(NO2-)>c(H+)>c(OH-)
C. c点混合溶液中:c(OH-)>c(HNO2)
D. d点混合溶液中:c(Na+)>c(OH-)>c(NO2-)>c(H+)
【答案】B
【解析】
试题A、HNO2的电离是吸热过程,温度越高电离平衡常数越大,而c高于b,所以电离平衡常数:c点>b点,故A正确;B、b点得到HNO2,和NaNO2混合溶液显酸性,说明电离大于水解,所以离子浓度大小为:c(NO2-)>c(Na+)>c(H+)>c(OH-),故B错误;C、a→c温度升高说明两者恰好完全中和,点两者恰好完全反应,而c→d温度降低,所水解为主,所以c点得到NaNO2溶液是强碱弱酸盐,水解溶液呈碱性,所以c(OH-)>c(HNO2),故C正确;D、d点混合溶液中当c(NaOH)较大时,得到NaOH和NaNO2混合溶液,所以离子的浓度为:c(Na+)>c(OH-)>c(NO2-)>c(H+),故D正确;故选B。


 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
【题目】下列有关物质用途的说法正确的是( )
A.SiO2是良好的半导体材料
B.NaOH可用于治疗胃酸过多
C.Na2O2可用作潜水艇的供氧剂
D.明矾可用作自来水的消毒剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,相关坐标图像错误的是( )
的是
A | B | C | D |
NaHSO4溶液中逐滴加入Ba(OH)2 溶液 | 向盐酸中滴入NaAlO2溶液 | 将铜粉加入到一定量浓硝酸中 | 将铁粉加入到一定量氯化铁溶液中 |
|
|
|
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.向久置的氯水中滴入紫色石蕊试液,溶液先变红后褪色
B.pH在5.6~7之间的降水通常称为酸雨
C.合金的硬度一般比成分金属的大
D.硫粉在过量的纯氧中燃烧可生成SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. ![]() 的一溴代物和
的一溴代物和![]() 的一溴代物都有4种(不考虑立体异构)
的一溴代物都有4种(不考虑立体异构)
B. CH3CH=CHCH3分子中的四个碳原子在同一直线上
C. 按系统命名法,化合物 的名称是2,3,4-三甲基-2-乙基戊烷
的名称是2,3,4-三甲基-2-乙基戊烷
D. ![]() 与
与![]() 都是α-氨基酸且互为同系物
都是α-氨基酸且互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用化学用语填空:
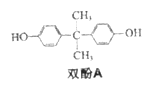
(1)双酚A的分子式________________。
(2)乙酸具有酸性____________。
(3)用系统命名法给如图所示的有机物命名________________。
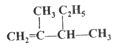
(4)2-甲基-1,3-丁二烯与Br2的CCl4溶液发生1,4-加成,化学方程式为____________。
(5)乙醛与银氨溶液反应的化学方程式为____________。
(6)如图所示有机物发生加聚反应的化学方程式为________________。
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当前煤炭在我国的能源消费中占60%以上,它在给我们提供廉价能源的同时,燃烧生成的SO2、NOx等也造成了比较严重的大气污染问题。
(1)向燃煤中加入CaO,煤中硫元素大多数会转化为CaSO4,故CaO能起到固硫、降低SO2排放量的作用。
已知:①SO2(g)+CaO(s)=CaSO3(s) △H=-402kJ·mol-1
②2CaSO3(s)+O2(g)=2CaSO4(s) △H =-234.2 kJ·mol-1
③CaCO3(s)=CO2(g)+CaO(s) △H=+178.2 kJ·mol-1
则反应2SO2(g)+O2(g)+2CaO(s)=2CaSO4(s) △H =____________kJ·mol-1。
(2)活性炭对NO2有较强的吸附性,二者之间可发生2C(s)+2NO2(g)![]() N2(g)+2CO2(g) △H,为研究温度、压强等外部因素对该反应的影响,某科研小组向密闭容器中加入2molNO2和足量的活性炭,进行如下实验探究:
N2(g)+2CO2(g) △H,为研究温度、压强等外部因素对该反应的影响,某科研小组向密闭容器中加入2molNO2和足量的活性炭,进行如下实验探究:
i.固定密闭容器的体积为5L,测得恒容时不同温度下NO2的转化率(ɑ)与时间(t)的关系如图1所示:
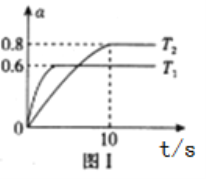
①该反应的△H_______0填“>”或“<”),温度为T2时,反应开始到达到平衡的时间段内v(N2)=__________________
②温度为T1时该反应的平衡常数K=____________________,若保持温度不变,提高NO2转化率的方法是________________________。
ⅱ.保持容器中的温度恒定,测得20s内,CO2的体积分数(φ)与压强(p)的关系如图Ⅱ所示。
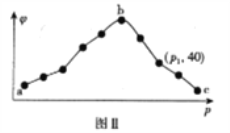
③图Ⅱ曲线呈现先增后减的变化趋势,其原因为____________________________________,压强为p1时,容器中c(NO2):c(N2)=____________________
(3)常温下,用NaOH溶液吸收SO2既可消除大气的污染,又可获得重要的化工产品,若某吸收液c(HSO3-):c(SO32-)=1:100,则所得溶被的pH=____________(常温下K1(H2SO3)=1.5×10-2、K2(H2SO3)=1×10-7)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式,正确的是( )
A. 澄清石灰水中通入过量二氧化硫:Ca2+ +2OH +SO2 ===CaSO3↓+H2O
B. 碳酸钠溶液中加入二氧化硅:CO32 +SiO2==SiO32 +CO2↑
C. 二氧化硅与烧碱溶液反应:SiO2 +2OH === SiO32+H2O
D. 硅酸与烧碱溶液中和:H2SiO3 +2OH === SiO32+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、我国规定生活用水中镉排放的最大允许浓度为0.005 mg/L。处理含镉废水可采用化学沉淀法。试回答下列问题:
(1)磷酸镉(Cd3(PO4)2)沉淀溶解平衡常数的表达式Ksp=________。
(2)一定温度下,CdCO3的Ksp=4.0 × 10-12,Cd(OH)2的Ksp=3.2 × 10-14,那么它们在水中的溶解量________较大。
(3)在某含镉废水中加人Na2S,当S2-浓度达到7.9 × 10-8mol/L时,水体中Cd2+浓度为_____mol/L(已知:Ksp(CdS)=7.9 × 10-27,Ar(Cd)=112);此时是否符合水源标准?______(填“是”或“否”)。
Ⅱ、炼锌烟尘(主要成份为ZnO,含少量CuO和FeO)为原料,可以制取氯化锌和金属锌。制取氯化锌主要工艺如下:
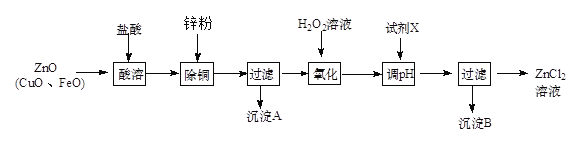
下表列出了相关金属离子生成氢氧化物沉淀的pH (开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
金属离子 | Fe3+ | Zn2+ | Fe2+ |
开始沉淀的pH | 1. 1 | 5. 2 | 5. 8 |
沉淀完全的pH | 3. 2 | 6. 4 | 8. 8 |
(1)加入H2O2溶液的作用是________________。
(2)流程图中,调节pH时,加入的试剂X可以是________(填序号)
A、ZnO B、NaOH C、Zn2(OH)2CO3 D、ZnSO4
pH应调整到_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com