
【题目】当前煤炭在我国的能源消费中占60%以上,它在给我们提供廉价能源的同时,燃烧生成的SO2、NOx等也造成了比较严重的大气污染问题。
(1)向燃煤中加入CaO,煤中硫元素大多数会转化为CaSO4,故CaO能起到固硫、降低SO2排放量的作用。
已知:①SO2(g)+CaO(s)=CaSO3(s) △H=-402kJ·mol-1
②2CaSO3(s)+O2(g)=2CaSO4(s) △H =-234.2 kJ·mol-1
③CaCO3(s)=CO2(g)+CaO(s) △H=+178.2 kJ·mol-1
则反应2SO2(g)+O2(g)+2CaO(s)=2CaSO4(s) △H =____________kJ·mol-1。
(2)活性炭对NO2有较强的吸附性,二者之间可发生2C(s)+2NO2(g)![]() N2(g)+2CO2(g) △H,为研究温度、压强等外部因素对该反应的影响,某科研小组向密闭容器中加入2molNO2和足量的活性炭,进行如下实验探究:
N2(g)+2CO2(g) △H,为研究温度、压强等外部因素对该反应的影响,某科研小组向密闭容器中加入2molNO2和足量的活性炭,进行如下实验探究:
i.固定密闭容器的体积为5L,测得恒容时不同温度下NO2的转化率(ɑ)与时间(t)的关系如图1所示:
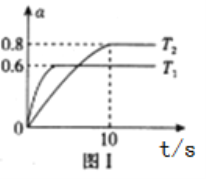
①该反应的△H_______0填“>”或“<”),温度为T2时,反应开始到达到平衡的时间段内v(N2)=__________________
②温度为T1时该反应的平衡常数K=____________________,若保持温度不变,提高NO2转化率的方法是________________________。
ⅱ.保持容器中的温度恒定,测得20s内,CO2的体积分数(φ)与压强(p)的关系如图Ⅱ所示。
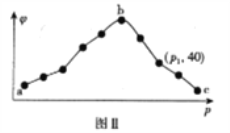
③图Ⅱ曲线呈现先增后减的变化趋势,其原因为____________________________________,压强为p1时,容器中c(NO2):c(N2)=____________________
(3)常温下,用NaOH溶液吸收SO2既可消除大气的污染,又可获得重要的化工产品,若某吸收液c(HSO3-):c(SO32-)=1:100,则所得溶被的pH=____________(常温下K1(H2SO3)=1.5×10-2、K2(H2SO3)=1×10-7)。
【答案】-1038.2<0.016mol·L-1·s -10.27分离出生成物b点前反应未达到平衡状态,压强增大,反应速率加快,CO2含量升高;b点后反应处于平衡状态,压强越大,越不利于反应向右进行2:19
【解析】
(1)已知:①SO2(g)+CaO(s)=CaSO3(s) △H=-402kJ·mol-1
②2CaSO3(s)+O2(g)=2CaSO4(s) △H =-234.2 kJ·mol-1
根据盖斯定律:①×2+②,得2SO2(g)+O2(g)+2CaO(s)=2CaSO4(s) △H =(-402kJ·mol-1)×2+(-234.2 kJ·mol-1)= -1038.2 kJ·mol-1,
故答案为:-1038.2;
(2)①由NO2的转化率(ɑ)与时间(t)关系图像可知,温度为T1时先达到平衡,根据温度越高反应越快可推出T1 >T2,由于T1时NO2的转化率低于T2时NO2的转化率,说明升高温度平衡向逆反应方向移动,可推出正反应为放热反应,所以△H<0,
温度为T2时,达到平衡时NO2的转化率为0.8,则:
2C(s)+2NO2(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
起始浓度(mol/L) 0.4 0 0
变化浓度(mol/L) 0.4×0.8 0.4×0.8![]() 0.4×0.8
0.4×0.8
平衡浓度(mol/L) 0.08 0.16 0.32
则反应开始到达到平衡的时间段内(10s),v(N2)=![]() =0.016mol·L-1·s -1,
=0.016mol·L-1·s -1,
故答案为:< ;0.016mol·L-1·s -1;
②温度为T1时,达到平衡时NO2的转化率为0.6,则:
2C(s)+2NO2(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
起始浓度(mol/L) 0.4 0 0
变化浓度(mol/L) 0.4×0.6 0.4×0.6![]() 0.4×0.6
0.4×0.6
平衡浓度(mol/L) 0.16 0.12 0.24
根据化学平衡常数的定义:K=![]() =
=![]() =0.27;
=0.27;
提高NO2的转化率,可以采取分离出生成物的方法,
故答案为:0.27;分离出生成物;
③b点前反应未达到平衡状态,压强增大,反应速率加快,CO2含量升高;b点后反应处于平衡状态,压强越大,越不利于反应向右进行;
由方程式可知,当CO2的体积分数为40%时,N2占20%,则NO2占1-40%-20%=40%,因此c(NO2):c(N2)=2:1;
故答案为:b点前反应未达到平衡状态,压强增大,反应速率加快,CO2含量升高;b点后反应处于平衡状态,压强越大,越不利于反应向右进行 ;2:1;
(3)![]() =
=![]() =
=![]() =
=![]() ,解得c(H+)=
,解得c(H+)=![]() mol/L=10-9mol·L-1,即pH=9。
mol/L=10-9mol·L-1,即pH=9。
故答案为:9。


科目:高中化学 来源: 题型:
【题目】下列表述合理的是
A. 苯与乙炔的实验式均是C2H2
B. 溴乙烷的比例模型是![]()
C. 羟基的电子式:![]()
D. NH3·H2O的电离方程式是NH3·H2O===NH4++OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组探究氨基甲酸铵(NH2COONH4)分解的化学平衡和水解反应速率。
(1)将一定量纯净的氨基甲酸铵置于固定容积为 100mL 的密闭真空溶液 A 中,在恒定温度下使其达到分解 平衡。实验测得不同温度下的平衡数据列于下表:
温度(℃) | 20.0 | 25.0 | 30.0 | 35.0 |
平衡气体总物质的量(mol) | 0.34 | 0.48 | 0.68 | 0.94 |
①氨基甲酸铵分解的化学方程式为 NH2COONH4(s) 2NH3(g)+CO2(g),若 25.0℃时达到平衡所用时间为8min,根据数据计算 NH3 的平均生成速率为__________。
②可以判断该分解反应已经达到化学平衡的是_____。
A. 2v(NH3)正=v(CO2)逆
B.密闭容器中总压强不变
C. 密闭容器中混合气体的密度不变
D. 密闭容器中氨气的体积分数不变
(2)已知:NH2COONH4+2H2O NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵 溶液测定水解反应速率,得到 c(NH2COO-)随时间变化趋势如图所示。根据图中信息,如何说明水解反应速率随温度升高而增大:_____。

(3)合成氨工业对国民经济和社会发展具有重要意义。工业合成氨常用的催化剂是_____,氨分子的电子式是_____。
(4)如图是一定的温度和压强下时 N2 和 H2 反应生成 1molNH3 过程中能量变化示意图,请写出工业合成氨的热化学反应方程式:__________________________。(热量 Q 的数值使用含字母 a、b 的代数式表示)

(5)在催化剂存在下,NH3 可用来消除 NO 的污染,生成两种对环境无害的物质。写出反应的化学方程式:_____________________;该反应中氧化产物与还原产物的物质的量之比是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若往20 mL 0.01 mol·L-1 HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示。下列有关说法不正确的是

A. HNO2的电离平衡常数:c点>b点
B. b点混合溶液显酸性:c(Na+)>c(NO2-)>c(H+)>c(OH-)
C. c点混合溶液中:c(OH-)>c(HNO2)
D. d点混合溶液中:c(Na+)>c(OH-)>c(NO2-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】严重的雾霾天气的形成与汽车尾气排放有关。汽车尾气中常含有CO、NOx等气体,为减轻污染,一般汽车都加装了“催化净化器”,可将汽车尾气中的有毒气体转化为无污染的气体。某化学兴趣小组在实验室模拟汽车尾气处理,设计了下图所示装置(部分夹持装置已略去)。
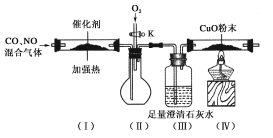
(1)装置(Ⅲ)的主要作用为________________________。
(2)停止加热,打开活塞K,放入适量氧气时,装置(Ⅱ)中可观察到的现象是___________________。
(3)该套装置中有不完善之处,还应在装置(Ⅳ)后补充____________。
(4)工业上常用纯碱液来吸收NOx,有关反应的化学方程式为2NO2+Na2CO3===NaNO2+NaNO3+CO2、NO2+NO+Na2CO3===2NaNO2+CO2。现有标准状况下a L NO2和b L NO的混合气体恰好被200 mL Na2CO3溶液完全吸收,则a、b应满足的关系为________。Na2CO3溶液的物质的量浓度为________mol·L-1(不必化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2012年中国汽车销量大幅增长,同时也带来了严重的空气污染.汽车尾气装置中,气体在催化剂表面吸附与解吸的过程如图所示,下列说法正确的是( )
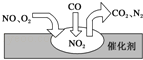
A.反应中NO为氧化剂,N2为氧化产物
B.汽车尾气的主要污染成分包括CO、NO和N2
C.NO和O2必须在催化剂表面才能反应
D.催化转化总反应为2NO+O2+4CO![]() 4CO2+N2
4CO2+N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种有机光电材料中间体。实验室由芳香化合物A制备H的一种合成路线如下:

已知:
①![]()
②![]()
回答下列问题:
(1)A物质的名称为________________。
(2)由C生成D和E生成F的反应类型分别为____________、____________。
(3)E的结构简式为________________。
(4)G为甲苯的同分异构体,由F生成H的化学方程式为____________。
(5)芳香化合物X是F的同分异构体,X能与饱和碳酸氢钠溶液反应放出CO2,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6:2:1:1,写出所有符合要求的X的结构简式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,不能按 ![]() (“―→”表示反应一步完成)关系转化的是( )
(“―→”表示反应一步完成)关系转化的是( )
选项 | a | b | c |
A | Al2O3 | NaAlO2 | Al(OH)3 |
B | AlCl3 | Al(OH)3 | NaAlO2 |
C | Al | Al(OH)3 | Al2O3 |
D | MgCl2 | Mg(OH)2 | MgO |
A. AB. BC. CD. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com