
【题目】化合物H是一种有机光电材料中间体。实验室由芳香化合物A制备H的一种合成路线如下:

已知:
①![]()
②![]()
回答下列问题:
(1)A物质的名称为________________。
(2)由C生成D和E生成F的反应类型分别为____________、____________。
(3)E的结构简式为________________。
(4)G为甲苯的同分异构体,由F生成H的化学方程式为____________。
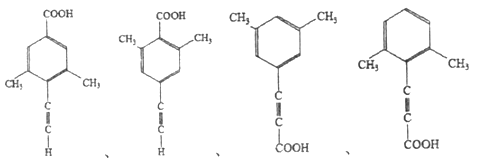
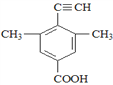
(5)芳香化合物X是F的同分异构体,X能与饱和碳酸氢钠溶液反应放出CO2,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6:2:1:1,写出所有符合要求的X的结构简式____________。
【答案】 苯甲醛 加成反应 取代反应 
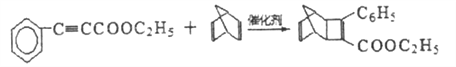
【解析】B含有一个氧原子,能与Cu(OH)2反应生成C,则B含有一个醛基,根据B的分子式,B的不饱和度为6,则B为![]() ;根据已知反应和条件,A为
;根据已知反应和条件,A为![]() ,C为
,C为 ;C与Br2发生加成生成D,则D为
;C与Br2发生加成生成D,则D为 ;D与KOH醇溶液共热后酸化得到E,则E为
;D与KOH醇溶液共热后酸化得到E,则E为![]() ;E与乙醇在浓硫酸加热的条件下生成F,则F为
;E与乙醇在浓硫酸加热的条件下生成F,则F为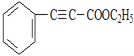 ;根据已知条件和H的结构简式,G为
;根据已知条件和H的结构简式,G为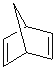 。
。
(1)根据上述分析,A为![]() ,名称是苯甲醛;正确答案:苯甲醛。
,名称是苯甲醛;正确答案:苯甲醛。
(2)根据以上分析可知由C生成D的反应为加成反应,由E生成F的反应为取代反应;正确答案:加成反应; 取代反应。
(3)根据上述分析,E的结构简式为![]() ;正确答案:
;正确答案: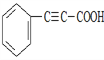 。
。
(4)根据已知条件,G的结构简式为 ,由F生成H的化学方程式为
,由F生成H的化学方程式为
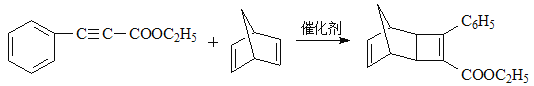 ;正确答案:
;正确答案: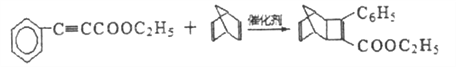 。
。
(5)X能与饱和碳酸氢钠溶液反应放出CO2,则X含有羧基(-COOH),核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6:2:1:1,则X的结构简式有4种,具体如下: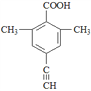 、
、 、
、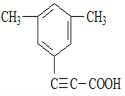 、
、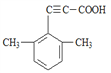 ;正确答案:
;正确答案: 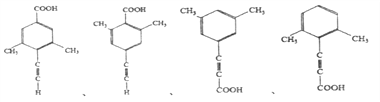 。
。


科目:高中化学 来源: 题型:
【题目】下列反应中,相关坐标图像错误的是( )
的是
A | B | C | D |
NaHSO4溶液中逐滴加入Ba(OH)2 溶液 | 向盐酸中滴入NaAlO2溶液 | 将铜粉加入到一定量浓硝酸中 | 将铁粉加入到一定量氯化铁溶液中 |
|
|
|
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当前煤炭在我国的能源消费中占60%以上,它在给我们提供廉价能源的同时,燃烧生成的SO2、NOx等也造成了比较严重的大气污染问题。
(1)向燃煤中加入CaO,煤中硫元素大多数会转化为CaSO4,故CaO能起到固硫、降低SO2排放量的作用。
已知:①SO2(g)+CaO(s)=CaSO3(s) △H=-402kJ·mol-1
②2CaSO3(s)+O2(g)=2CaSO4(s) △H =-234.2 kJ·mol-1
③CaCO3(s)=CO2(g)+CaO(s) △H=+178.2 kJ·mol-1
则反应2SO2(g)+O2(g)+2CaO(s)=2CaSO4(s) △H =____________kJ·mol-1。
(2)活性炭对NO2有较强的吸附性,二者之间可发生2C(s)+2NO2(g)![]() N2(g)+2CO2(g) △H,为研究温度、压强等外部因素对该反应的影响,某科研小组向密闭容器中加入2molNO2和足量的活性炭,进行如下实验探究:
N2(g)+2CO2(g) △H,为研究温度、压强等外部因素对该反应的影响,某科研小组向密闭容器中加入2molNO2和足量的活性炭,进行如下实验探究:
i.固定密闭容器的体积为5L,测得恒容时不同温度下NO2的转化率(ɑ)与时间(t)的关系如图1所示:
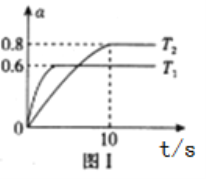
①该反应的△H_______0填“>”或“<”),温度为T2时,反应开始到达到平衡的时间段内v(N2)=__________________
②温度为T1时该反应的平衡常数K=____________________,若保持温度不变,提高NO2转化率的方法是________________________。
ⅱ.保持容器中的温度恒定,测得20s内,CO2的体积分数(φ)与压强(p)的关系如图Ⅱ所示。
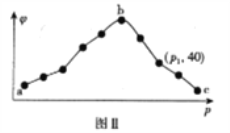
③图Ⅱ曲线呈现先增后减的变化趋势,其原因为____________________________________,压强为p1时,容器中c(NO2):c(N2)=____________________
(3)常温下,用NaOH溶液吸收SO2既可消除大气的污染,又可获得重要的化工产品,若某吸收液c(HSO3-):c(SO32-)=1:100,则所得溶被的pH=____________(常温下K1(H2SO3)=1.5×10-2、K2(H2SO3)=1×10-7)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式,正确的是( )
A. 澄清石灰水中通入过量二氧化硫:Ca2+ +2OH +SO2 ===CaSO3↓+H2O
B. 碳酸钠溶液中加入二氧化硅:CO32 +SiO2==SiO32 +CO2↑
C. 二氧化硅与烧碱溶液反应:SiO2 +2OH === SiO32+H2O
D. 硅酸与烧碱溶液中和:H2SiO3 +2OH === SiO32+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 浓硫酸是一种干燥剂,能够干燥氢气、氧气、氨气等气体,但不能干燥有较强还原性的HI、H2S等气体
B. 浓硫酸与单质碳反应的化学方程式为C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O,在此反应中,浓硫酸既表现了强氧化性又表现了酸性
CO2↑+2SO2↑+2H2O,在此反应中,浓硫酸既表现了强氧化性又表现了酸性
C. 把足量铜粉投入到含H2SO4 2 mol的浓硫酸中,得到气体体积标准状况下为22.4 L
D. 常温下能够用铁、铝等容器盛放浓硫酸,是因为浓硫酸的强氧化性使其钝化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生课外活动小组利用下图所示装置分别做如下实验:
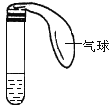
(1)在试管中注入某红色溶液,加热试管,气球胀大,溶液颜色逐渐变浅,冷却后气球干瘪,溶液颜色恢复红色,则原溶液可能是________________溶液;加热时,溶液由红色逐渐变浅的原因是:______________。
(2)在试管中注入某无色溶液,加热试管,气球胀大,溶液变为红色,冷却后气球干瘪,溶液颜色恢复无色,则此溶液可能是________________溶液;加热时溶液由无色变为红色的原因是:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能影响水的电离平衡,并使溶液中的c(H+)>c(OH-)的措施是( )
A. 向水中通入SO2 B. 将水加热煮沸
C. 向纯水中投入一小块金属钠 D. 向水中加入NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、我国规定生活用水中镉排放的最大允许浓度为0.005 mg/L。处理含镉废水可采用化学沉淀法。试回答下列问题:
(1)磷酸镉(Cd3(PO4)2)沉淀溶解平衡常数的表达式Ksp=________。
(2)一定温度下,CdCO3的Ksp=4.0 × 10-12,Cd(OH)2的Ksp=3.2 × 10-14,那么它们在水中的溶解量________较大。
(3)在某含镉废水中加人Na2S,当S2-浓度达到7.9 × 10-8mol/L时,水体中Cd2+浓度为_____mol/L(已知:Ksp(CdS)=7.9 × 10-27,Ar(Cd)=112);此时是否符合水源标准?______(填“是”或“否”)。
Ⅱ、炼锌烟尘(主要成份为ZnO,含少量CuO和FeO)为原料,可以制取氯化锌和金属锌。制取氯化锌主要工艺如下:
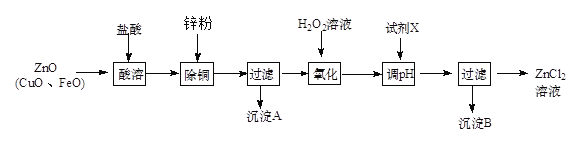
下表列出了相关金属离子生成氢氧化物沉淀的pH (开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
金属离子 | Fe3+ | Zn2+ | Fe2+ |
开始沉淀的pH | 1. 1 | 5. 2 | 5. 8 |
沉淀完全的pH | 3. 2 | 6. 4 | 8. 8 |
(1)加入H2O2溶液的作用是________________。
(2)流程图中,调节pH时,加入的试剂X可以是________(填序号)
A、ZnO B、NaOH C、Zn2(OH)2CO3 D、ZnSO4
pH应调整到_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大,其中Z为金属且Z的原子序数为W的2倍。n、p、q是由这些元素组成的二元化合物,常温下,n为气体。m、r、s分别是Z、W、X的单质,t的水溶液呈碱性焰色反应呈黄色,上述物质间的转化关系如图所示。下列说法正确的是
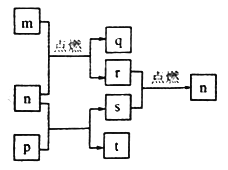
A. 简单离子半径:Z>Y>X B. 化合物P中只存在离子键
C. 图示转化关系涉及的反应均为氧化还原反应 D. 最简单气态氢化物的稳定性:W>X
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com