
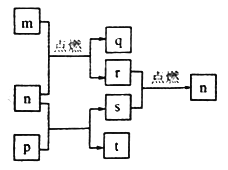
【题目】短周期元素W、X、Y、Z的原子序数依次增大,其中Z为金属且Z的原子序数为W的2倍。n、p、q是由这些元素组成的二元化合物,常温下,n为气体。m、r、s分别是Z、W、X的单质,t的水溶液呈碱性焰色反应呈黄色,上述物质间的转化关系如图所示。下列说法正确的是
A. 简单离子半径:Z>Y>X B. 化合物P中只存在离子键
C. 图示转化关系涉及的反应均为氧化还原反应 D. 最简单气态氢化物的稳定性:W>X
【答案】C
【解析】短周期元素W、X、Y、Z的原子序数依次增大,其中Z为金属且Z的原子序数为W的2倍,则Z的原子序数为偶数,Z应为Mg,W为C;n、p、q是由这些元素组成的二元化合物,常温下,n为气体.m、r、s分别是Z、W、X的单质,t的水溶液呈碱性焰色反应呈黄色,结合图中转化可知,m为Mg,n为CO2,q为MgO,r为C,p为Na2O2,t为Na2CO3,s为O2,则X为O,Y为Na。
A. 具有相同核外电子排布的离子中,原子序数大的离子半径小,则离子半径为X>Y>Z,故A错误;B. p为Na2O2,含离子键、OO非极性键,故B错误;C. Mg与二氧化碳反应、过氧化钠与二氧化碳反应、C与氧气反应中均有元素的化合价变化,所以均为氧化还原反应,故C正确;D. 非金属性O>C,则最简单气态氢化物的稳定性为X>W,故D错误;答案选C。


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
【题目】下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中.正确的是( )

A. 常压下五种元素的单质中Z单质的沸点最高
B. Y、Z的阴离子电子层结构都与R原子的相同
C. W的氢化物沸点比X的氢化物的沸点高
D. Y元素的非金属性比W元素的非金属性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
B元素原子的核外p电子数比s电子数少1 |
C原子的第一至第四电离能分别是 I1=738 kJ/mol;I2=1 451 kJ/mol;I3=7 733 kJ/mol;I4=10 540 kJ/mol |
D原子核外所有p轨道全满或半满 |
E元素的主族序数与周期数的差为4 |
F是前四周期中电负性最小的元素 |
G在周期表的第七列 |
(1)已知BA5为离子化合物,写出其电子式______________________________。
(2)B基态原子中能量最高的电子,其电子云在空间有________个方向,原子轨道呈________形。
(3)某同学根据上述信息,推断C基态原子的核外电子排布为![]() 该同学所画的电子排布图违背了_____________________________________。
该同学所画的电子排布图违背了_____________________________________。
(4)G位于________族________区,价电子排布式为________。
(5)检验F元素的方法是________,请用原子结构的知识解释产生此现象的原因是_____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对一些实验事实的理论解释正确的是( )
选项 | 实验事实 | 理论解释 |
A | 氮原子的第一电离能大于氧原子 | 氮原子2p能级半充满 |
B | CO2为直线形分子 | CO2分子中 |
C | 金刚石的熔点低于石墨 | 金刚石是分子晶体,石墨是原子晶体 |
D | HF的沸点高于HCl | HF的相对分子质量小于HCl |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法完全正确的是( )
A.放热反应均是自发反应
B.如果ΔH和ΔS 均为正值,当温度升高时,反应可能自发进行
C.ΔS为正值的反应均是自发反应
D.物质的量增加的反应,ΔS为正值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:
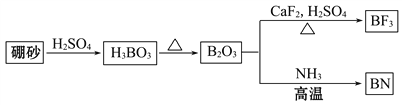
请回答下列问题:
(1)由B2O3制备BF3、BN的化学方程式依次是________________________、__________________________。
(2)基态B原子的电子排布式为________,B和N相比,电负性较大的是________,BN中B元素的化合价为________。
(3)在BF3分子中,F—B—F的键角是________,B原子的杂化轨道类型为________,BF3和过量NaF作用可生成NaBF4,BF4-的立体构型为________。
(4)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________,层间作用力为________。
(5)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5 pm。立方氮化硼晶胞中含有________个氮原子、________个硼原子,立方氮化硼的密度是________g·cm-3(只要求列算式,不必计算出数值。阿伏加德罗常数为NA)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com