
【题目】根据物质的组成分类,Na2SO4不属于( )
A.钠盐B.硫酸盐C.正盐D.酸式盐
 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:
【题目】传统的定量化学实验受到计量手段的制约而研究范围狭窄、精确度不高。DIS数字化信息系统(由传感器、数据采集器和计算机组成)因为可以准确测量溶液的pH等,所以在中和滴定的研究中应用越来越广泛。
(1)某学习小组利用DIS系统测定某醋酸溶液的物质的量浓度,以测量溶液导电能力来判断滴定终点,实验步骤如下:
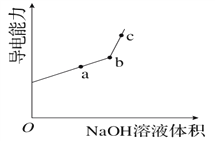
①用__________(填仪器名称)量取20.00 mL醋酸溶液样品,倒入洁净干燥锥形瓶中,连接好DIS系统。如果锥形瓶中含有少量蒸馏水,测量结果将______________(选填“偏大”、“偏小”或“不影响”)。向锥形瓶中滴加0.1000 mol·L-1的NaOH溶液,计算机屏幕上显示出溶液导电能力与加入NaOH溶液体积关系的曲线图如下图。

②醋酸与NaOH溶液反应的离子方程式为___________________________。
③图中b点时,溶液中各离子浓度大小的关系是_________________。
④若图中某一点pH等于8,则c(Na+)—c(CH3COO-)的精确值为________。
(2)将体积为10 mL pH=2的醋酸溶液与HX溶液分别加水稀释至1 000 mL,稀释过程pH的变化曲线如图所示,则HX的电离平衡常数________(填“大于”“等于”或“小于”,下同)醋酸的电离平衡常数;稀释后,HX溶液中由水电离出来的c(H+)______醋酸溶液中由水电离出来的 c(H+)。
(3)25 ℃时,CH3COOH的电离平衡常数K=1.8×10-5。在0.5 mol·L-1的CH3COOH溶液中由CH3COOH电离出的c(H+)约是由水电离出的c(H+)的______倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子结构与元素周期表存在着内在联系,根据已学知识请你回答下列问题。
(1)指出31号元素镓(Ga)在元素周期表中的位置:第_______周期______族。
(2)写出原子序数最小的Ⅷ族元素原子的核外电子排布式:_____________________________。
(3)写出3p轨道上只有2个未成对电子的元素的符号:________、________,二者电负性________>________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肯定属于同族元素且性质相似的是( )
A. 原子核外电子排布式:A为1s22s2,B为1s2
B. 结构示意图:A为![]() ,B为
,B为![]()
C. A原子基态时2p轨道上有1个未成对电子,B原子基态时3p轨道上也有1个未成对电子
D. A原子基态时2p轨道上有一对成对电子,B原子基态时3p轨道上也有一对成对电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大。
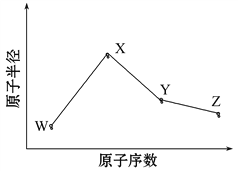
(1)X位于元素周期表中第________周期第________族;W的基态原子核外有________个未成对电子。
(2)Z的气态氢化物和溴化氢相比,较稳定的是________(写化学式)。
(3)Y与Z形成的化合物和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式是____________________________________________________。
(4)在25 ℃、101 kPa下,已知Y的气态氢化物在氧气中完全燃烧后恢复至原状态,平均每转移1 mol电子放热190.0 kJ,该反应的热化学方程式是_________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大,其中Z为金属且Z的原子序数为W的2倍。n、p、q是由这些元素组成的二元化合物,常温下,n为气体。m、r、s分别是Z、W、X的单质,t的水溶液呈碱性焰色反应呈黄色,上述物质间的转化关系如图所示。下列说法正确的是
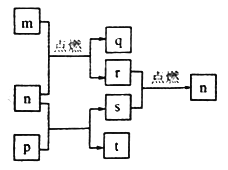
A. 简单离子半径:Z>Y>X B. 化合物P中只存在离子键
C. 图示转化关系涉及的反应均为氧化还原反应 D. 最简单气态氢化物的稳定性:W>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取来两份等浓度的NaOH溶液A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.2mol/L的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,试回答下列问题:
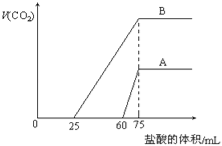
(1)原NaOH溶液的物质的量浓度为 mol/L.
(2)曲线A表明,原NaOH溶液中通入CO2后,所得溶液中的溶质为(写化学式) ;其物质的量之比为 .
(3)曲线B表明,原NaOH溶液中通入CO2后,所得溶液加盐酸产生CO2气体体积(标准状况)的最大值为 mL.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关晶体的结构如图所示,下列说法中不正确的是 ( )


A. 在NaCl晶体中,距Na+最近的Cl-形成正八面体
B. 在CaF2晶体中,每个晶胞平均占有4个Ca2+
C. 在金刚石晶体中,碳原子与碳碳键个数的比为1∶2
D. 该气态团簇分子的分子式为EF或FE
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com