
【题目】下列事实一定能说明HF是弱酸的是( )
①常温下NaF溶液的pH大于7; ②用HF溶液做导电性实验,灯泡很暗;
③HF与NaCl不能发生反应; ④常温下0.1mol/L的HF溶液的pH为2.3
⑤HF能与Na2CO3溶液反应,产生CO2气体 ⑥HF与水能以任意比混溶
⑦1mol/L的HF水溶液能使紫色石蕊试液变红
A. ①④ B. ②③⑤ C. ③④⑥ D. ①②⑦
【答案】A
【解析】
①如果常温下NaF溶液的pH大于7,则NaF属于强碱弱酸盐,它水解使溶液显碱性:F-+H2O![]() HF+OH-,可推知HF一定是弱酸,①项正确;
HF+OH-,可推知HF一定是弱酸,①项正确;
②用HF溶液做导电性实验时,缺少了等浓度等体积的一元强酸(如HCl)的对照实验,故该事实不能说明HF一定是弱酸,②项错误;
③根据强酸制弱酸的原理,HF与NaCl不能发生反应,可推知HF可能是弱酸或是强酸。③项错误;
④由题意知常温下0.1mol/L的HF溶液中c(H+)=10-2.3mol/L<0.1mol/L,可推断HF不能完全电离,所以该事实一定能说明HF是弱酸,④项正确;
⑤根据强酸制弱酸的原理,HF能与Na2CO3溶液反应,可推断HF的酸性比H2CO3强,但不能确定HF是强酸还是弱酸,⑤项错误;
⑥由“HF与水能以任意比混溶”无法判断HF的电离程度,所以该事实不能说明HF一定是弱酸,⑥项错误;
⑦由“1mol/L的HF水溶液能使紫色石蕊试液变红”可推知HF溶液显酸性,HF可能是强酸也可能是弱酸,⑦项错误;答案选A。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】(1)当前,环境治理已成为重要的民生工程。
①2014年1月,教育部规定在学校公共场所禁止吸烟。下列有关说法中不正确的是_____(填字母代号,下同)。
A.吸烟会对室内和公共场所造成污染
B.吸入焦油、尼古丁及颗粒物可导致多种病变
C.N2、 CO2、CO和尼古丁都属于室内空气污染物
②下列做法可能会加重“雾霾”的是______。
A.大量焚烧秸杆
B.在汽车尾气系统装置催化转化器
C.发展煤的气化和液化等洁净煤技术
③下列处理垃圾的方法中,不正确的是____。
A.回收利用废纸
B.回收利用易拉罐
C.填埋废旧电池
④垃圾处理遵循无害化、减量化和资源化的原则。垃圾分类收集是实观上述原则的措施之—。贴有下图标示,表示为________
![]()
A.可回收物 B.有害垃圾 C.其他垃圾
⑤我国城市发布的“空气质量日报”中,下列物质不列入首要污染物的是____。
A.二氧化硫 B.二氧化碳 C.二氧化氮 D.可吸入颗粒物
(2)材料是人类赖以生存和发展的重要物质基础。
①试管、烧怀和烧瓶等化学仪器的主要材质是____ (填字母代号)。
A.玻璃 B. 陶瓷
②钢铁是目前用最大的铁合金。钢铁接触海水发生电化学腐蚀,其负极反应式为______;因此,为防止轮船船体被腐蚀,可在船体上安装一定量的______(填“锌”成“铜”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀溶液中含有4 mol KNO3和2.5 mol H2SO4,向其中加入1.5 mol Fe,充分反应(已知NO3-被还原为NO),最终溶液体积为1L。下列说法正确的是
A. 所得溶液中c(NO3-)=2.75 mol·L-1
B. 所得溶液中c(Fe2+):c(Fe3+)=1:2
C. 反应后生成NO的体积为33.6 L(标准状况下)
D. 所得溶液中的溶质只有FeSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z、T、U五种短周期元素。X、Y、Z 三元素在周期表中的位置如图所示,三元素的原子序数之和是 41。X 和 T 的单质在不同条件下反应,可以生成T2X(白色固体)和T2X2(淡黄色固体)两种化合物。U 单质在 Z 单质中燃烧时产生苍白色火焰,生成物的水溶液能使石蕊试液变红。
X | |
Y | Z |
(1)各元素的符号是 X______,Y______,Z______。
(2)Y 原子的结构示意图为_______。
(3)用电子式表示 Y 与 T 组成的化合物的形成过程:______。
(4)YX2 和 U2Y 反应的化学方程式为______, 其中氧化剂是______,被氧化的元素是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸亚铬[(CH3COO)2Cr·H2O]为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂。一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价铬;二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。实验装置如图所示,回答下列问题:

(1)实验中所用蒸馏水均需经煮沸后迅速冷却,目的是_________,仪器a的名称是_______。
(2)将过量锌粒和氯化铬固体置于c中,加入少量蒸馏水,按图连接好装置,打开K1、K2,关闭K3。
①c中溶液由绿色逐渐变为亮蓝色,该反应的离子方程式为_________。
②同时c中有气体产生,该气体的作用是_____________。
(3)打开K3,关闭K1和K2。c中亮蓝色溶液流入d,其原因是________;d中析出砖红色沉淀,为使沉淀充分析出并分离,需采用的操作是___________、_________、洗涤、干燥。
(4)指出装置d可能存在的缺点______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水氯化铝是一种重要的化工原料,工业上利用明矾石制备无水氯化铝的流程如下,请回答下列问题:

(1) 实验室中,可制得Cl2的组合是____________(填代号)。
①MnO2和浓盐酸混合共热 ②MnO2、NaCl和浓硫酸混合共热
③NaClO和盐酸混合共热 ④漂白粉和硫酸混合共热
(2) 吸收焙烧炉中产生的尾气,下列装置合理的是___________(填代号)。

(3)写出氧化炉中反应的化学方程式_____________。
(4)生产氯化铝的过程中焙烧炉和氯化炉中产生的SO2、Cl2等大气污染物,若将二者按照一定比例通入水中可减少污染。试设计简单实验检验二者是否恰好完全反应,简要描述实验步骤、现象和结论_____________(仪器自选)。
可供选择试剂如下:
①滴加酚酞的氢氧化钠溶液 ②氣化亚铁溶液 ③硫氰化钾溶液 ④品红溶液
(5)某同学设计用如下装置验证二氧化硫的某些化学性质。

① 能说明二氧化硫具有氧化性的实验现象为____________。
② 写出a瓶中发生反应的离子方程式________________。
③ 充分反应后,取a瓶中的溶液分成三份,分别进行如下实验。
实验I:向第一份溶液中加入足量的NaOH溶液,生成白色沉淀,迅速变为灰绿色,最终变为红褐色。
实验II:向第二份溶液中加入少量KMnO4溶液,紫色褪去。
实验III:向第三份溶液中加人BaCl2溶液,生成白色沉淀。
上述实验中能充分证明二氧化硫具有还原性的是__________(填实验代号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C、I和气体甲、乙、丙及物质D、E、F、G、H。其中B是地壳中含量最多的金属。它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
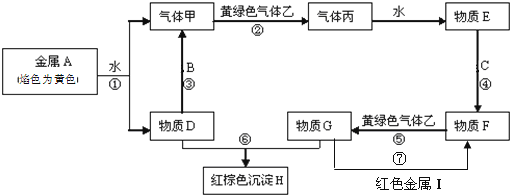
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:C__________、H_________。
(2)写出反应③的化学方程式:___________________。
写出反应⑦的化学方程式:___________________。
写出反应⑥的离子方程式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.(1)实验测得 8 g 液态甲醇(化学式为 CH4O)在氧气中完全燃烧,生成二氧化碳气体和液态水时释放出 181.6 kJ 的热量。请写出表示液态甲醇燃烧热的热化学方程式:_______。
(2)发射卫星时常用肼(N2H4)作为燃料,用二氧化氮作为氧化剂,这两种物质反应生成氮气和水蒸气。 已知:①N2(g)+2O2(g)=2NO2(g) ΔH= a kJ/mol;②N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH= b kJ/mol。写出肼气体与二氧化氮气体反应的热化学方程式:_______。
II.某学习小组的同学在实验室利用下图装置进行中和热的测定,请回答下列问题:

(1)在其它操作正确的前提下,如果大烧杯不盖硬纸板,求得的中和热 ΔH 将_______(填“偏大”、“偏小” 或“无影响”)。
(2)取 50 mL 0.50 mol/L NaOH 溶液和 30 mL 0.50 mol/L 硫酸溶液进行实验,实验数据如下表。
实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.5 | 26.7 | 26.6 | 30.1 | |
2 | 26.0 | 26.4 | 26.2 | 30.3 | |
3 | 25.9 | 25.9 | 25.9 | 30.2 | |
4 | 26.4 | 26.2 | 26.3 | 30.5 | |
①表中的温度差的平均值为_____℃。
②近似认为 0.50 mol/L NaOH溶液和 0.50 mol/L硫酸溶液的密度都是 1 g·cm-3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热 ΔH=_____kJ/mol (保留到小数点后一位)。
③实验中改用 60 mL0.50 mol/L 盐酸跟 50 mL 0.55 mol/L 氢氧化钠进行反应,若其它实验操作均正确,则与上述实验相比,所放出的热量_____(填“相等”或“不相等”,下同),所求得的中和热_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物W用作调香剂、高分子材料合成的中间体等,制备W的一种合成路线如下。

请回答下列问题:
(1)F的化学名称是________,⑤的反应类型是________。
(2)E中含有的官能团是________(写名称),D聚合生成高分子化合物的结构简式为________。
(3)将反应③得到的产物与O2在催化剂、加热的条件下反应可得D,写出反应④的化学方程式________。
(4)④、⑤两步能否颠倒?________(填“能”或“否”)理由是________。
(5)与A具有含有相同官能团的芳香化合物的同分异构体还有________种(不含立体异构),其中核磁共振氢谱为六组峰,且峰面积之比为1:1:2:2:2:2的结构简式为________。
(6)参照有机物W的上述合成路线,以M和CH3Cl为原料制备F的合成路线(无机试剂任选)________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com