
【题目】I.(1)实验测得 8 g 液态甲醇(化学式为 CH4O)在氧气中完全燃烧,生成二氧化碳气体和液态水时释放出 181.6 kJ 的热量。请写出表示液态甲醇燃烧热的热化学方程式:_______。
(2)发射卫星时常用肼(N2H4)作为燃料,用二氧化氮作为氧化剂,这两种物质反应生成氮气和水蒸气。 已知:①N2(g)+2O2(g)=2NO2(g) ΔH= a kJ/mol;②N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH= b kJ/mol。写出肼气体与二氧化氮气体反应的热化学方程式:_______。
II.某学习小组的同学在实验室利用下图装置进行中和热的测定,请回答下列问题:

(1)在其它操作正确的前提下,如果大烧杯不盖硬纸板,求得的中和热 ΔH 将_______(填“偏大”、“偏小” 或“无影响”)。
(2)取 50 mL 0.50 mol/L NaOH 溶液和 30 mL 0.50 mol/L 硫酸溶液进行实验,实验数据如下表。
实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.5 | 26.7 | 26.6 | 30.1 | |
2 | 26.0 | 26.4 | 26.2 | 30.3 | |
3 | 25.9 | 25.9 | 25.9 | 30.2 | |
4 | 26.4 | 26.2 | 26.3 | 30.5 | |
①表中的温度差的平均值为_____℃。
②近似认为 0.50 mol/L NaOH溶液和 0.50 mol/L硫酸溶液的密度都是 1 g·cm-3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热 ΔH=_____kJ/mol (保留到小数点后一位)。
③实验中改用 60 mL0.50 mol/L 盐酸跟 50 mL 0.55 mol/L 氢氧化钠进行反应,若其它实验操作均正确,则与上述实验相比,所放出的热量_____(填“相等”或“不相等”,下同),所求得的中和热_____。
【答案】CH4O(l)+![]() O2(g)=CO2(g)+ 2H2O(l) ΔH=﹣726.4kJ/mol(CH4O也可写为CH3OH) 2N2H4(g)+2NO2(g)=3N2(g)+ 4H2O(g) ΔH=(2b-a)kJ/mol〔或者ΔH=﹣(a -2b)kJ/mol〕
O2(g)=CO2(g)+ 2H2O(l) ΔH=﹣726.4kJ/mol(CH4O也可写为CH3OH) 2N2H4(g)+2NO2(g)=3N2(g)+ 4H2O(g) ΔH=(2b-a)kJ/mol〔或者ΔH=﹣(a -2b)kJ/mol〕
写成N2H4(g)+NO2(g)=![]() N2(g)+ 2H2O(g) ΔH=
N2(g)+ 2H2O(g) ΔH=![]() kJ/mol〔或者ΔH=﹣
kJ/mol〔或者ΔH=﹣![]() kJ/mol〕 偏大 4.2 ﹣56.2 不相等 相等
kJ/mol〕 偏大 4.2 ﹣56.2 不相等 相等
【解析】
I.(1)8g CH4O(物质的量为0.25mol)与O2反应,生成CO2和液态水,放热181.6 kJ,则可计算出1mol CH4O完全燃烧所放出的热量,由此可写出液态甲醇燃烧热的热化学方程式。
(2)①N2(g)+2O2(g)=2NO2(g) ΔH= a kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH= b kJ/mol
利用盖斯定律,将②×2-①,便可得出肼气体与二氧化氮气体反应的热化学方程式。
II.(1)在其它操作正确的前提下,如果大烧杯不盖硬纸板,则所测得的反应后混合物的温度低,由此确定求得的中和热 ΔH的变化。
(2)①去除误差大的第1组数据,另三组计算平均值,由此可得出表中的温度差的平均值。
②先利用公式计算反应放出的热量Q=cmt,然后换算为生成1molH2O所释放的热量,从而求得中和热ΔH。
③改用 60 mL 0.50 mol/L 盐酸跟 50 mL 0.55 mol/L 氢氧化钠进行反应,参加反应的反应物的物质的量不同,则放出的热量不同,由反应热概念确定所求得的中和热如何变化。
I.(1)8g CH4O(物质的量为0.25mol)与O2反应,生成CO2和液态水,放热181.6 kJ,则1mol CH4O完全燃烧放出热量:181.6 kJ×4 =726.4kJ,所以表示液态甲醇燃烧热的热化学方程式为CH4O(l)+![]() O2(g)=CO2(g)+ 2H2O(l) ΔH=﹣726.4kJ/mol(CH4O也可写为CH3OH)。答案为:CH4O(l)+
O2(g)=CO2(g)+ 2H2O(l) ΔH=﹣726.4kJ/mol(CH4O也可写为CH3OH)。答案为:CH4O(l)+![]() O2(g)=CO2(g)+ 2H2O(l) ΔH=﹣726.4kJ/mol(CH4O也可写为CH3OH);
O2(g)=CO2(g)+ 2H2O(l) ΔH=﹣726.4kJ/mol(CH4O也可写为CH3OH);
(2)①N2(g)+2O2(g)=2NO2(g) ΔH= a kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH= b kJ/mol
利用盖斯定律,将②×2-①,便可得出肼气体与二氧化氮气体反应的热化学方程式为2N2H4(g)+2NO2(g)=3N2(g)+ 4H2O(g) ΔH=(2b-a)kJ/mol〔或者ΔH=﹣(a -2b)kJ/mol〕,
或写成N2H4(g)+NO2(g)=![]() N2(g)+ 2H2O(g) ΔH=
N2(g)+ 2H2O(g) ΔH=![]() kJ/mol〔或者ΔH=﹣
kJ/mol〔或者ΔH=﹣![]() kJ/mol〕。答案为:2N2H4(g)+2NO2(g)=3N2(g)+ 4H2O(g) ΔH=(2b-a)kJ/mol〔或者ΔH=﹣(a -2b)kJ/mol〕,或写成N2H4(g)+NO2(g)=
kJ/mol〕。答案为:2N2H4(g)+2NO2(g)=3N2(g)+ 4H2O(g) ΔH=(2b-a)kJ/mol〔或者ΔH=﹣(a -2b)kJ/mol〕,或写成N2H4(g)+NO2(g)=![]() N2(g)+ 2H2O(g) ΔH=
N2(g)+ 2H2O(g) ΔH=![]() kJ/mol〔或者ΔH=﹣
kJ/mol〔或者ΔH=﹣![]() kJ/mol〕;
kJ/mol〕;
II.(1)在其它操作正确的前提下,如果大烧杯不盖硬纸板,则反应放出的热量易散失,所测得的反应后混合物的温度偏低,因为中和热 ΔH为负值,所以中和热 ΔH偏大。答案为:偏大;
(2)①去除误差大的第1组数据,另三组温度差的平均值为![]() ℃=4.2℃。答案为:4.2;
℃=4.2℃。答案为:4.2;
②50 mL 0.50 mol/L NaOH 溶液和 30 mL 0.50 mol/L 硫酸溶液,生成H2O的物质的量为0.025mol,放出的热量Q=cmt=4.18×10-3 kJ/(g·℃)×80g×4.2℃=1.4025kJ,则生成1molH2O所释放的热量为![]() =56.2kJ/mol,从而求得中和热ΔH=﹣56.2 kJ/mol。答案为:kJ/mol;
=56.2kJ/mol,从而求得中和热ΔH=﹣56.2 kJ/mol。答案为:kJ/mol;
③改用 60 mL 0.50 mol/L 盐酸跟 50 mL 0.55 mol/L 氢氧化钠进行反应,则生成H2O的物质的量为0.0275mol,则放出的热量不相等,但中和热是指生成1mol水所放出的热量,与参加反应的量无关,所以中和热相等。答案为:不相等;相等。


 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】有6种短周期元素,原子序数按E、D、B、A、F、C的顺序依次增大;A、C同周期,B、C同主族;A与B可形成离子化合物A2B,且离子的电子数均相同;D和E可形成4核10电子的分子;F是第三周期元素的简单离子中半径最小的。试回答下列问题(用相应的元素符号表示):
(1)写出B在元素周期表中的位置:__;C的原子结构示意图为__。
(2)B与E形成的化合物E2B2的电子式为__;D和E形成4核10电子的分子的结构式为___;A、B、E形成的化合物中存在的化学键___。
(3)元素A与元素F相比,金属性较弱的是__(用元素符号表示),写出实验室制备其最高价氧化物的水化物反应的离子方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实一定能说明HF是弱酸的是( )
①常温下NaF溶液的pH大于7; ②用HF溶液做导电性实验,灯泡很暗;
③HF与NaCl不能发生反应; ④常温下0.1mol/L的HF溶液的pH为2.3
⑤HF能与Na2CO3溶液反应,产生CO2气体 ⑥HF与水能以任意比混溶
⑦1mol/L的HF水溶液能使紫色石蕊试液变红
A. ①④ B. ②③⑤ C. ③④⑥ D. ①②⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对金属制品进行搞腐蚀处理,可延长其使用寿命。
(1)以下为铝村表面处理的一种方法:

①碱洗的目的是除去铝村表面的自然氧化膜,碱洗衣时候常有气泡冒出,原因是:________(用离子方程式表示)。为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的__________。
a.NH3b.CO2c.NaOH d.HNO3
②以铝村为阳极,在H2SO4溶液中电解,铝村表面形成氧化膜,阳极电极反应式为:_____。
取少量废电解液,加入NaHCO3溶液后产生气泡和白色沉淀,产生沉淀的原因是_________。
(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨做阳极的原因是 。
(3)利用下图装置,可以模拟铁的电化学防护。

若X为碳棒,为减缓铁的腐蚀,开关K应该置于 处。
若X为锌,开关K置于M处,该电化学防护法称为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是以环戊烷为原料制备环戊二烯的合成路线,下列说法正确的是( )
![]()
A. ![]() 的结构简式为
的结构简式为![]()
B. 反应④的反应试剂和反应条件是浓![]() 加热
加热
C. ①②③的反应类型分别为卤代、水解、消去
D. 环戊二烯与![]() 以1∶1的物质的量之比加成可生成
以1∶1的物质的量之比加成可生成![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:

注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为_____________________。
(2)向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,溶液的pH_________ (填“增大”、“不变”或“减小”)。
(3)“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是___________。
(4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。阳极的电极反应式为_____________________,阴极产生的物质A的化学式为____________。
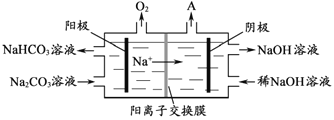
(5)铝粉在1000℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为CaF2、H3BO3(层状结构,层内的H3BO3分子通过氢键结合)、金属铜三种晶体的结构示意图,请回答下列问题:


图Ⅲ 铜晶体中铜原子堆积模型
(1)图Ⅰ所示的CaF2晶体中与Ca2+最近且等距离的F-数为________________,图Ⅲ中未标号的铜原子形成晶体后周围最紧邻的铜原子数为__________________________________。
(2)图Ⅱ所示的物质结构中最外能层已达8电子结构的原子是________,H3BO3晶体中B原子个数与极性键个数比为____________。
(3)金属铜具有很好的延展性、导电性、传热性,对此现象最简单的解释是用________理论。
(4)三种晶体中熔点最低的是________(填化学式),其晶体受热熔化时,克服的微粒之间的相互作用为____________________________________________________________。
(5)已知两个距离最近的Ca2+核间距离为a×10-8cm,结合CaF2晶体的晶胞示意图,CaF2晶体的密度为_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素 R、X、T、Z、Q 在元素周期表中的相对位置如图所示,其中 R 的氢化物的水溶液可以用来刻蚀玻璃,则下列判断正确的是( )

A.气态氢化物的酸性:R>T>Q
B.气态氢化物的还原性:X>T
C.R 与 Q 的电子数相差 16
D.R 的单质通入 T 的钠盐溶液中能置换出T 的单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于敞口容器中的化学反应:Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g),下列叙述中不正确的是( )

A. Zn和H2SO4的总能量大于ZnSO4和H2的总能量
B. 反应过程中能量关系可用上图表示
C. 若将该反应设计成原电池,则Zn为负极
D. 若将该反应设计成原电池,当有32.5g锌溶解时正极放出22.4 L气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com