
【题目】下面是以环戊烷为原料制备环戊二烯的合成路线,下列说法正确的是( )
![]()
A. ![]() 的结构简式为
的结构简式为![]()
B. 反应④的反应试剂和反应条件是浓![]() 加热
加热
C. ①②③的反应类型分别为卤代、水解、消去
D. 环戊二烯与![]() 以1∶1的物质的量之比加成可生成
以1∶1的物质的量之比加成可生成![]()
 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:
【题目】某温度时,CuS、MnS在水中的沉淀溶解平衡曲线如图所示,下列说法错误的是
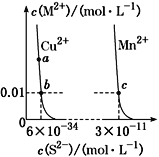
A. 在含有CuS和MnS固体的溶液中c(Cu2+)∶c(Mn2+)=1∶2×10-23
B. 向CuSO4溶液中加入MnS发生反应:
Cu2+(aq)+MnS(s)![]() CuS(s)+Mn2+(aq)
CuS(s)+Mn2+(aq)
C. a点对应的Ksp等于b点对应的Ksp
D. 该温度下,Ksp(CuS)小于Ksp(MnS)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸亚铬[(CH3COO)2Cr·H2O]为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂。一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价铬;二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。实验装置如图所示,回答下列问题:

(1)实验中所用蒸馏水均需经煮沸后迅速冷却,目的是_________,仪器a的名称是_______。
(2)将过量锌粒和氯化铬固体置于c中,加入少量蒸馏水,按图连接好装置,打开K1、K2,关闭K3。
①c中溶液由绿色逐渐变为亮蓝色,该反应的离子方程式为_________。
②同时c中有气体产生,该气体的作用是_____________。
(3)打开K3,关闭K1和K2。c中亮蓝色溶液流入d,其原因是________;d中析出砖红色沉淀,为使沉淀充分析出并分离,需采用的操作是___________、_________、洗涤、干燥。
(4)指出装置d可能存在的缺点______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C、I和气体甲、乙、丙及物质D、E、F、G、H。其中B是地壳中含量最多的金属。它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
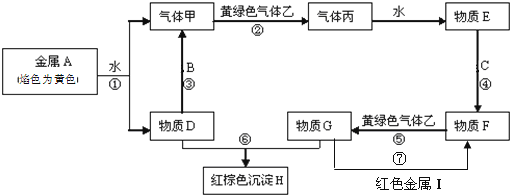
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:C__________、H_________。
(2)写出反应③的化学方程式:___________________。
写出反应⑦的化学方程式:___________________。
写出反应⑥的离子方程式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求对下图中两极进行必要的联接并填空:

(1)在A图中,使铜片上冒H2气泡。请加以必要的
联接,则联接后的装置叫____________。电极反应式:
锌板:_____________________;铜板:_______________________。
(2)在B图中,若a,b为惰性电极,使a极析出铜,则b析出:_________________。
加以必要的联接后,该装置叫________________。电极反应式,a极:______________________ b极:______________________。经过一段时间后,停止反应并搅均溶液,溶液的pH值__________(升高、降低、不变),加入一定量的_________后,溶液能恢复至与电解前完全一致。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.(1)实验测得 8 g 液态甲醇(化学式为 CH4O)在氧气中完全燃烧,生成二氧化碳气体和液态水时释放出 181.6 kJ 的热量。请写出表示液态甲醇燃烧热的热化学方程式:_______。
(2)发射卫星时常用肼(N2H4)作为燃料,用二氧化氮作为氧化剂,这两种物质反应生成氮气和水蒸气。 已知:①N2(g)+2O2(g)=2NO2(g) ΔH= a kJ/mol;②N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH= b kJ/mol。写出肼气体与二氧化氮气体反应的热化学方程式:_______。
II.某学习小组的同学在实验室利用下图装置进行中和热的测定,请回答下列问题:

(1)在其它操作正确的前提下,如果大烧杯不盖硬纸板,求得的中和热 ΔH 将_______(填“偏大”、“偏小” 或“无影响”)。
(2)取 50 mL 0.50 mol/L NaOH 溶液和 30 mL 0.50 mol/L 硫酸溶液进行实验,实验数据如下表。
实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.5 | 26.7 | 26.6 | 30.1 | |
2 | 26.0 | 26.4 | 26.2 | 30.3 | |
3 | 25.9 | 25.9 | 25.9 | 30.2 | |
4 | 26.4 | 26.2 | 26.3 | 30.5 | |
①表中的温度差的平均值为_____℃。
②近似认为 0.50 mol/L NaOH溶液和 0.50 mol/L硫酸溶液的密度都是 1 g·cm-3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热 ΔH=_____kJ/mol (保留到小数点后一位)。
③实验中改用 60 mL0.50 mol/L 盐酸跟 50 mL 0.55 mol/L 氢氧化钠进行反应,若其它实验操作均正确,则与上述实验相比,所放出的热量_____(填“相等”或“不相等”,下同),所求得的中和热_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于区域3的是( )

A.2F2+2H2O═4HF+O2
B.AgNO3+NaCl═AgCl↓+NaNO3
C.3CO+Fe2O3 ![]() 2Fe+3CO2
2Fe+3CO2
D.MgCl2(熔融)![]() Mg+Cl2↑
Mg+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A. 向![]() 溶液中滴加氨水至过量:
溶液中滴加氨水至过量:![]()
B. 向![]() 悬浊液中滴加
悬浊液中滴加![]() 溶液:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+
溶液:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+
C. 向![]() 溶液中加入足量稀硫酸:2S2O32-+4H+=SO42-+3S↓+2H2O
溶液中加入足量稀硫酸:2S2O32-+4H+=SO42-+3S↓+2H2O
D. 向苯酚钠溶液中通入少量![]() 气体:2C6H5O-+CO2+H2O=2C6H5OH+CO32-
气体:2C6H5O-+CO2+H2O=2C6H5OH+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(乙二酸)可作还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产。一种制备草酸(含2个结晶水)的工艺流程如右:

回答下列问题:
(1)CO和NaOH在一定条件下合成甲酸钠、甲酸钠加热脱氢的化学反应方程式分别为:__________________、_______________。
(2)该制备工艺中有两次过滤操作,过滤操作①的滤液是___________,滤渣是________;过滤操作②的滤液是____________和____________,滤渣是_______。
(3)工艺过程中③和④的目的是______________。
(4)有人建议甲酸钠脱氢后直接用硫酸酸化制备草酸。该方案的缺点是产品不纯,其中含有的杂质主要是____________________。
(5)结晶水合草酸成品的纯度用高锰酸钾法测定。
称量草酸成品0.250 g溶于水,用0.0500 mol·L-1的酸性KMnO4溶液滴定,至浅粉红色不消褪,消耗KMnO4溶液15.00 mL,反应的离子方程式为__________________;
列式计算该成品的纯度____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com