
【题目】下列反应的离子方程式正确的是( )
A. 向![]() 溶液中滴加氨水至过量:
溶液中滴加氨水至过量:![]()
B. 向![]() 悬浊液中滴加
悬浊液中滴加![]() 溶液:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+
溶液:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+
C. 向![]() 溶液中加入足量稀硫酸:2S2O32-+4H+=SO42-+3S↓+2H2O
溶液中加入足量稀硫酸:2S2O32-+4H+=SO42-+3S↓+2H2O
D. 向苯酚钠溶液中通入少量![]() 气体:2C6H5O-+CO2+H2O=2C6H5OH+CO32-
气体:2C6H5O-+CO2+H2O=2C6H5OH+CO32-
【答案】B
【解析】
A.向AgNO3溶液中滴加氨水至过量,会形成银氨络离子,反应的离子方程式为:Ag++2NH3·H2O=[Ag(NH3)2]++2H2O,A错误;
B.由于Mg(OH)2的溶解度大于Fe(OH)3的溶解度,所以向Mg(OH)2悬浊液中滴加FeCl3溶液,会发生沉淀转化,形成Fe(OH)3沉淀,离子反应为3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+,B正确;
C.向Na2S2O3溶液中加入足量稀硫酸,发生反应生成Na2SO4、单质S、SO2、H2O,离子方程式为:S2O32-+2H+=S↓+SO2↑+H2O,C错误;
D.向苯酚钠溶液中通入少量CO2气体,发生反应生成苯酚和碳酸氢钠,反应的离子方程式为:C6H5O-+CO2+H2O=C6H5OH+HCO3-,D错误;
故合理选项是B。


科目:高中化学 来源: 题型:
【题目】在硫酸铜晶体结晶水含量测定的实验中,会造成实验结果偏低的是( )
A. 加热时间过长,固体部分变黑B. 坩埚内附有不挥发杂质
C. 晶体不纯,含有不挥发杂质D. 加热过程中有少量晶体溅出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是以环戊烷为原料制备环戊二烯的合成路线,下列说法正确的是( )
![]()
A. ![]() 的结构简式为
的结构简式为![]()
B. 反应④的反应试剂和反应条件是浓![]() 加热
加热
C. ①②③的反应类型分别为卤代、水解、消去
D. 环戊二烯与![]() 以1∶1的物质的量之比加成可生成
以1∶1的物质的量之比加成可生成![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为CaF2、H3BO3(层状结构,层内的H3BO3分子通过氢键结合)、金属铜三种晶体的结构示意图,请回答下列问题:


图Ⅲ 铜晶体中铜原子堆积模型
(1)图Ⅰ所示的CaF2晶体中与Ca2+最近且等距离的F-数为________________,图Ⅲ中未标号的铜原子形成晶体后周围最紧邻的铜原子数为__________________________________。
(2)图Ⅱ所示的物质结构中最外能层已达8电子结构的原子是________,H3BO3晶体中B原子个数与极性键个数比为____________。
(3)金属铜具有很好的延展性、导电性、传热性,对此现象最简单的解释是用________理论。
(4)三种晶体中熔点最低的是________(填化学式),其晶体受热熔化时,克服的微粒之间的相互作用为____________________________________________________________。
(5)已知两个距离最近的Ca2+核间距离为a×10-8cm,结合CaF2晶体的晶胞示意图,CaF2晶体的密度为_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素。在一定条件下它们之间的相互转化关系如图所示(部分反应中的H2O已略去)。

请回答下列问题:
(1)若A是黄绿色的气体,D是铁单质。则B是____________(填化学式),反应③的离子方程式为__________________。
(2)若A是一种有刺激性气味的气体,其水溶液呈碱性;B和C是常见的氧化物且C是红棕色气体。则反应①的化学方程式为____________,A的用途有____________(任写一种)。
(3)若A、C、D都是气体,B是一种(淡)黄色的固体单质,C是形成酸雨的主要物质。在标准状况下,反应③中消耗6.72L的A,则转移的电子数为____________。
(4)若A是钠盐,B俗称小苏打,则反应②的离子方程式为____________;配制250mL0.1mol·L-1Na2CO3溶液,需要用托盘天平称量Na2CO310H2O晶体的质量为____________克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素 R、X、T、Z、Q 在元素周期表中的相对位置如图所示,其中 R 的氢化物的水溶液可以用来刻蚀玻璃,则下列判断正确的是( )

A.气态氢化物的酸性:R>T>Q
B.气态氢化物的还原性:X>T
C.R 与 Q 的电子数相差 16
D.R 的单质通入 T 的钠盐溶液中能置换出T 的单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微型纽扣电池在现代生活中有广泛应用,有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,总反应为Ag2O+Zn=ZnO+2Ag,其中一个电极反应为Ag2O+H2O+2e-=2Ag+2OH-。

(1)正极材料为___________。
(2)写出另一电极的电极反应式__________。
(3)在电池使用的过程中,电解质溶液中KOH的物质的量怎样变化?________(增大、减小、不变)。
(4)当电池工作时通过电路对外提供了1mol电子,计算消耗的负极的质量_______。
(5)利用下列反应:Fe+2Fe3+=3Fe2+设计一个原电池,请选择适当的材料和试剂。
①电解质溶液为_____________。
②负极反应式:____________________。
③溶液中Fe3+向__________极移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)下列生产、生活中的事例中没有发生氧化还原反应的是____(填写字母代号)
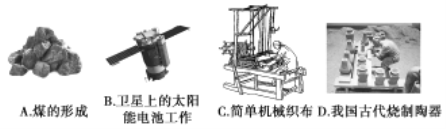
(2)水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”可用如图表达。
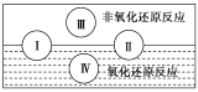
试写出有水参加的符合反应类型Ⅳ的一个化学方程式:_____,其中水为______剂。
(3)过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称;如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O=A+NH3↑,试指出生成物A的化学式为___,并阐明H2O2被称为绿色氧化剂的理由是_______。
(4)氯化铵常用作焊接。如:在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为:____CuO+___NH4Cl![]() ____Cu+___CuCl2+___N2↑+___H2O。
____Cu+___CuCl2+___N2↑+___H2O。
①配平此氧化还原反应方程式。
②该反应中,被氧化的元素是______(填元素名称),氧化剂是____(填化学式)。
③反应中若产生0.2mol的气体,则有_____mol的电子转移。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时草酸(H2C2O4)的电离常数为K1=5.0×10-2,K2=5.4×10-5,草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9。不同温度下水的离子积常数见下表:
t/℃ | 0 | 10 | 20 | 25 | 40 | 50 | 90 | 100 |
Kw/10-14 | 0.134 | 0.292 | 0.681 | 1.00 | 2.92 | 5.57 | 38.0 | 55.0 |
(1)常温下将0.2 mol/L的KOH溶液20 mL与0.2 mol/L的草酸溶液20 mL混合后溶液显酸性,则混合后溶液中各离子浓度的大小顺序为__________________________________;
(2)已知草酸能使酸性高锰酸钾溶液(稀硫酸酸化)褪色,若在锥形瓶中放入20.00mL未知浓度的草酸,用0.1mol/L高锰酸钾溶液滴定,当到达滴定终点时,若共消耗VmL高锰酸钾溶液,则草酸的物质的量浓度为__________mol/L。
(3)90℃时,将0.005 mol/L的氢氧化钙溶液20 mL与0.0012 mol/L的草酸溶液20 mL混合,混合后溶液的pH=___________;
(4)25℃时若向20 mL草酸钙的饱和溶液中逐滴加入8.0×10-4 mol/L的碳酸钾溶液10 mL,能否产生沉淀,___________(填“能”或“否”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com