
����Ŀ������Ӧ�ù㷺�Ľ�������������(��Ҫ�ɷ�ΪAl2O3����SiO2��Fe2O3������)Ϊԭ���Ʊ�����һ�ֹ����������£�

ע��SiO2����������ʱת��Ϊ�������Ƴ�����
��1����������ʱ����ƫ�����Ƶ����ӷ���ʽΪ_____________________��
��2������������������Һ�м���NaHCO3��Һ����Һ��pH_________ (��������������������������С��)��
��3����������ǵ������Al2O3������������������ʯī�����ģ�ԭ����___________��
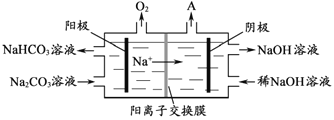
��4����������ǵ��Na2CO3��Һ��ԭ����ͼ��ʾ�������ĵ缫��ӦʽΪ_____________________����������������A�Ļ�ѧʽΪ____________��
��5��������1000��ʱ����N2��Ӧ�Ʊ�AlN������������������NH4Cl���岢��ֻ�ϣ�������AlN���Ʊ�������Ҫԭ����_____________________��
���𰸡�Al2O3+2OH=2![]() +H2O��Сʯī�缫�������ϲ�����O2������4
+H2O��Сʯī�缫�������ϲ�����O2������4![]() +2H2O4e=4
+2H2O4e=4![]() +O2��H2NH4Cl�ֽ������HCl�ܹ��ƻ�Al�����Al2O3��Ĥ
+O2��H2NH4Cl�ֽ������HCl�ܹ��ƻ�Al�����Al2O3��Ĥ
��������
����������Ҫ�ɷ�ΪAl2O3����SiO2��Fe2O3�����ʣ�Ϊԭ���Ʊ����������̿�֪����NaOH�ܽ�ʱFe2O3����Ӧ������Ϣ��֪SiO2�ڡ����ܡ�ʱת��Ϊ�������Ƴ��������˵õ�������ΪFe2O3���������ƣ�̼��������ƫ�����Ʒ�Ӧ����Al��OH��3������II�õ�Al��OH��3���������������������IΪ�������������Al�����������IIΪ���Na2CO3��Һ�����ͼ��֪��������̼�������ʧȥ��������̼��������Ӻ������������������ӵõ���������������
��1����������ʱ����ƫ�����Ƶ����ӷ���ʽΪ��Al2O3+2OH-==2AlO2-+H2O����2����������I��������Һ�м���NaHCO3��Һ����NaAlO2��Ӧ������������������̼���ƣ�����ΪOH����AlO2����CO32������֪��Һ��pH��С��NaHCO3�д��ڻ�ѧ���У����Ӽ����ۼ�����3�������I���ǵ������Al2O3������������������ʯī�����ģ�ԭ����ʯī�缫�������ϲ�����O2��������4����ͼ��֪��������ӦΪ4CO32��+2H2O-4e���T4HCO3��+O2���������������ӵõ�������������������������������A�Ļ�ѧʽΪH2����5��������1000��ʱ����N2��Ӧ�Ʊ�AlN������������������NH4Cl���岢��ֻ�ϣ�������AlN���Ʊ�������Ҫԭ����NH4Cl�ֽ������HCl�ܹ��ƻ�Al�����Al2O3��Ĥ��


 �¿α�����Ķ�ѵ��ϵ�д�
�¿α�����Ķ�ѵ��ϵ�д� ������������Ӧ����ϵ�д�
������������Ӧ����ϵ�д� ͬ����չ�Ķ�ϵ�д�
ͬ����չ�Ķ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֮�乲��һ��̼ԭ�ӵĻ������Ϊ�ݻ������1��4-��������[2.2]����Ľṹ��ʽΪ![]() ������˵����ȷ����
������˵����ȷ����
A. 1mol���л�����ȫȼ����Ҫ4molO2
B. ���л����� HCOOCH=CH2��Ϊͬ���칹��
C. ���л���Ķ��ȴ�����3��
D. ���л�������ԭ�Ӿ�����ͬһƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ϡ���ᡢ����ʯ��ˮ���Ȼ�ͭ��Һ�dz��л�ѧ�г��������ʣ��������ʼ�ķ�Ӧ��ϵ��ͼ��ʾ��ͼ����Բ�ཻ����(A��B��C��D)��ʾ���ʼ�ķ�Ӧ�����ж�Ӧ�ĸ���Ӧ���͵�˵����ȷ����

A. ���ֽⷴӦ�����ֽⷴӦ�����Ϸ�Ӧ���û���Ӧ
B. �кͷ�Ӧ���û���Ӧ�����ֽⷴӦ���û���Ӧ
C. ���ֽⷴӦ�����ֽⷴӦ���û���Ӧ���û���Ӧ
D. �ֽⷴӦ�����ֽⷴӦ���û���Ӧ���û���Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊʹ������ι̣�����Ĵ��Ų��ø������������𣬸������dz��߷������ľ���ϩ���ϣ�ͬʱҲʹ������һ�ֽз���(���ӽṹ��ͼ��ʾ)�ĸ����ܲ��ϣ����¶������ֲ��ϵ�˵���������
![]()
A. ������һ�ֻ����
B. ����ϩ��ʹ��ˮ��ɫ
C. ����ϩ�ͷ��ڵķ���������Ȼ�����н���������������ɻ���ѹ��
D. �ϳɷ��ڵķ�Ӧ����ʽΪ��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������Ҫ�Ʊ��������Ȼ��ء����к�����KBr��K2SO4���Ȼ�����Ʒ��������ͼ��ʾ��ʵ�鷽�������ᴿ��

(1)KCl��K+����ʱ������ɫ�ܲ����۲���ɫΪ��___________��
(2) �������ᱵ�������Ȼ��������ж��Ƿ���У�______����ǡ�������˵�����ɣ�________��
(3)�ڹ��˺����Һ��ͨ������������ɽ���Һ�е�KBr���ʳ�ȥ�������ķ�ӦΪ��2KBr + Cl2 = 2KCl + Br2��������Ƿ���Ԫ�صĻ��ϼ۷����˱仯�����࣬�÷�Ӧ����_______________��Ӧ��
(4) ijͬѧ��Ϊ��ʵ�鷽���м������Ȼ�����Һ�������ƣ�Ӧ��������Ȼ�����Һ������˼·���¡���д������A�Ļ�ѧʽ��A��_________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״��ڹ�ҵ���й�������;
��֪����2CH3OH(l)+2O2(g)=2CO(g)+4H2O(l) ��H=��a kJ��mol��1
��2CO(g)+O2(g)=2CO2(g) ��H=��b kJ��mol��1
(1)��Ӧ2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(1)�ġ�H=___________��
(2)CH3OH�����ȼ��ʱ������C��CO��CO2�Լ���̬ˮ�������еIJ���ͨ��һ��10L���ܱ������У���һ�������·������淴Ӧ��
CO(g)+ H2O(g)![]() CO2(g)+H2(g) ��H>0
CO2(g)+H2(g) ��H>0
�����������COƽ��ת���ʵ�������___________��(����ȷ�𰸱��)
A.���� B.���� C.��ѹ D.��ѹ
��������ʵ��˵���÷�Ӧ�ﵽƽ�����___________��(����ȷ�𰸱��)
A.��ϵ�е���ɫ�������仯 B. v��(CO)/v��(H2)=1
C.c(CO)/c(H2)=1 D.CO2��Ũ�Ȳ��ٷ����仯
������ܱ������г���2 mol CO��4.8molH2O����200���£�20���Ӻ�ﵽƽ�⣬���CO��ת����Ϊ60%��v(CO2)=___________�����¶��µ�ƽ�ⳣ����___________��
(3)�ڼ����������ü״����෨�Ʊ�CO��H2ʱ�������ü�NiO������������2CH3OH(l)![]() 2CO(g)+4H2(g) ��H>0���ղ������¶ȵĹ�ϵ��ͼ��ʾ��
2CO(g)+4H2(g) ��H>0���ղ������¶ȵĹ�ϵ��ͼ��ʾ��
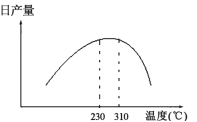
�ٱ�֤�ϸ��ղ����������¶���______________��
��310���Ժ��ղ����½���ԭ�������___________��
(4)21���ͼ״�ȼ�ϵ������Ѷ���Դ֮һ���״�������س�Ϊ�˳��ص�أ���ȼ�ϵ�ع���ʱ�ĵ�ط�Ӧ��2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(1)��ԭ����ͼ
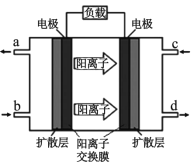
��c��Ӧͨ��_________________________________��
�ڸõ�صĸ�����ӦʽΪ_________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л�����ϩ������ȥ��ϩ�õ������ļ��飬������ͨ��ʢ��������һ���Լ���ϴ��ƿ�� ��
A������ʯ��ˮ��ŨH2SO4
B������KMnO4��Һ��ŨH2SO4
C����ˮ��ŨH2SO4
D��ŨH2SO4��NaOH��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£�xA��yB![]() zC�ķ�Ӧ�ﵽƽ�⡣
zC�ķ�Ӧ�ﵽƽ�⡣
��1����֪A��B��C�������壬�ڼ�ѹ��ƽ�����淴Ӧ�����ƶ�����x��y��z֮��Ĺ�ϵ��__________________��
��2����֪C�����壬��x��y��z��������ѹǿʱ�����ƽ�ⷢ���ƶ�����ƽ��һ����_____________�ƶ���
��3����֪B��C�����壬�������������䣬����A�����ʵ���ʱ��ƽ�ⲻ�����ƶ�����A��_____________̬���ʡ�
��4�������Ⱥ�C�������������٣�������Ӧ��_________��������������������������Ӧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ȱ��ķ�ˮ��ͨ���������������ƣ���Ƴ������ؽ��ȱ�ת��Ϊ������ȥ����ԭ����ͼ��ʾ������������ȷ����

A. �ȱ����������ɱ�
B. N��Ϊ��صĸ���
C. M���缫��ӦʽΪ��C6H5Cl +e��=Cl��+ C6H6
D. ÿ����1 mol CO2����N��������M������H+Ϊ3mol
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com