
【题目】铁、稀盐酸、澄清石灰水、氯化铜溶液是初中化学中常见的物质,四种物质间的反应关系如图所示。图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应四个反应类型的说法正确的是

A. 复分解反应、复分解反应、化合反应、置换反应
B. 中和反应、置换反应、复分解反应、置换反应
C. 复分解反应、复分解反应、置换反应、置换反应
D. 分解反应、复分解反应、置换反应、置换反应
【答案】C
【解析】
酸碱中和反应属于两种化合物相互交换成分生成另外两种化合物的反应,为复分解反应,氢氧化钙和稀盐酸反应生成氯化钙和水,所以A为复分解反应、中和反应;B的反应属于两种化合物相互交换成分生成另外两种化合物的反应,为复分解反应,氢氧化钙和氯化铜反应生成氢氧化铜沉淀和氯化钙,所以B为复分解反应;C的反应为一种单质和一种化合物反应生成另外的单质和化合物的反应,属于置换反应,Fe和氯化铜反应生成Cu和氯化亚铁,所以C属于置换反应;D的反应为一种单质和一种化合物反应生成另外的单质和化合物的反应,属于置换反应,铁和稀盐酸反应生成氯化亚铁和氢气,所以D属于置换反应;故答案为C。


科目:高中化学 来源: 题型:
【题目】氧化二氯(C12O)是次氯酸的酸酐,用作氯化剂其部分性质如下:
物理性质 | 化学性质 |
常温下,C12O是棕黄色刺激性气体。 熔点:-120.6℃;沸点2.0℃ | C12O不稳定接触一般有机物易爆炸;它易溶于水,同时反应生成次氯酸。 |
实验室制备原理2Na2CO3+H2O+2Cl2![]() 2NaCl +2NaHCO3+ C12O, 现用下列装置设计实验制备少量C12O,并探究相关物质的性质。
2NaCl +2NaHCO3+ C12O, 现用下列装置设计实验制备少量C12O,并探究相关物质的性质。

(1)装置A中仪器X的名称为___________。
(2)若气体从左至右流动装置连接顺序是A、___________(每个装置限用一次)。
(3)装置F中盛装试剂的名称为___________。
(4)A中反应的离子方程式为___________。
(5)当D中收集适量液态物质时停止反应,设计简单实验证明B中残留固体中含有NaHCO3:___________。
(6)实验完成后取E中烧杯内溶液滴加品红溶液发现溶液褪色。该课题组设计实验探究溶液褪色的原因。
序号 | 0.1mol/LNaClO溶液/mL | 0.1mol/LNaCl溶液/mL | 0.1mol/LNaOH溶液/mL | H2O/mL | 品红溶液 | 现象 |
I | 5.0 | 0 | 0 | 5.0 | 3滴 | 较快褪色 |
II | 0 | 5.0 | a | 0 | 3滴 | 不褪色 |
III | 5.0 | 0 | 0 | 3滴 | 缓慢褪色 |
①a=___________。
②由上述实验得出的结论是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明,大气中氮氧化物和碳氢化合物受紫外线作用可产生二次污染物——光化学烟雾,其中某些反应过程如图所示。下列说法不正确的是

A. 整个过程中O3作催化剂
B. 反应III的方程式为O2+O===O3
C. 光化学烟雾中含甲醛、乙醛等刺激性物质
D. 反应I、反应Ⅱ均属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t ℃下,某反应达到平衡,平衡常数 ![]() 。恒容时,温度升高,NO浓度减小。下列说法正确的是( )
。恒容时,温度升高,NO浓度减小。下列说法正确的是( )
A. 该反应正反应的焓变为正值 B. 恒温下扩大容器体积,反应体系的颜色加深
C. 升高温度,逆反应速率减小 D. 该反应化学方程式为NO2+SO2 ![]() NO+SO3
NO+SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡: ![]() ,
,![]() 。然后在恒定温度下缩小容器体积,重新达到平衡。下列分析正确的是
。然后在恒定温度下缩小容器体积,重新达到平衡。下列分析正确的是
A. 若![]() ,则该反应达到平衡状态
,则该反应达到平衡状态
B. 两次平衡时,后一次平衡时![]() 的浓度大
的浓度大
C. 重新达到平衡,密闭容器中氨气的体积分数不变
D. 若开始时向容器中加人2molNH3和1molCO2,则达到平衡时放出akJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝在生活中具有广泛用途。现从含铝废料(含有A12O3的质量分数为51%,其余为NiO、SiO2、Fe3O4)中制取金属铝的流程如下:

回答下列问题:
(1)工艺过程中常把废料研细,其目的是_________________________________。
(2)步骤I中得到的滤渣的主要成分是___________(填化学式)。步骤V的反应类型是______________________。
(3)步骤Ⅱ中加入稀双氧水的目的是______________________。
(4)步骤Ⅲ产生NiCO3的离子方程式是___________。步骤Ⅳ产生沉淀的离子方程式是______________________。
(5)工业中常用惰性电极熔融电解法制备金属铝,其阴极反应式为___________。
(6)若用a吨该含铝废料通过上述流程,理论上可以生产铝___________吨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:

注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为_____________________。
(2)向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,溶液的pH_________ (填“增大”、“不变”或“减小”)。
(3)“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是___________。
(4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。阳极的电极反应式为_____________________,阴极产生的物质A的化学式为____________。
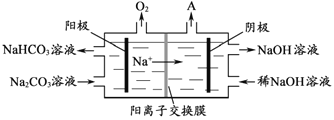
(5)铝粉在1000℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com