
【题目】为使桥体更牢固,港珠澳大桥采用高性能绳索吊起,该绳索是超高分子量的聚乙烯材料,同时也使用了另一种叫芳纶(分子结构下图所示)的高性能材料,以下对这两种材料的说法错误的是
![]()
A. 芳纶是一种混合物
B. 聚乙烯能使溴水褪色
C. 聚乙烯和芳纶的废弃物在自然环境中降解速率慢,会造成环境压力
D. 合成芳纶的反应方程式为:![]()
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案科目:高中化学 来源: 题型:
【题目】在密闭容器中通入一定量的HI气体,使其在一定条件下发生反应:2HI(g)![]() H2(g)+I2(g)。下列叙述中,一定属于平衡状态的是
H2(g)+I2(g)。下列叙述中,一定属于平衡状态的是
A. HI、H2、I2的浓度相等
B. 混合气体的颜色不再变化
C. 混合气体的总压强不再变化
D. v(HI)∶v(H2)∶v(I2)=2∶1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明,大气中氮氧化物和碳氢化合物受紫外线作用可产生二次污染物——光化学烟雾,其中某些反应过程如图所示。下列说法不正确的是

A. 整个过程中O3作催化剂
B. 反应III的方程式为O2+O===O3
C. 光化学烟雾中含甲醛、乙醛等刺激性物质
D. 反应I、反应Ⅱ均属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡: ![]() ,
,![]() 。然后在恒定温度下缩小容器体积,重新达到平衡。下列分析正确的是
。然后在恒定温度下缩小容器体积,重新达到平衡。下列分析正确的是
A. 若![]() ,则该反应达到平衡状态
,则该反应达到平衡状态
B. 两次平衡时,后一次平衡时![]() 的浓度大
的浓度大
C. 重新达到平衡,密闭容器中氨气的体积分数不变
D. 若开始时向容器中加人2molNH3和1molCO2,则达到平衡时放出akJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝在生活中具有广泛用途。现从含铝废料(含有A12O3的质量分数为51%,其余为NiO、SiO2、Fe3O4)中制取金属铝的流程如下:

回答下列问题:
(1)工艺过程中常把废料研细,其目的是_________________________________。
(2)步骤I中得到的滤渣的主要成分是___________(填化学式)。步骤V的反应类型是______________________。
(3)步骤Ⅱ中加入稀双氧水的目的是______________________。
(4)步骤Ⅲ产生NiCO3的离子方程式是___________。步骤Ⅳ产生沉淀的离子方程式是______________________。
(5)工业中常用惰性电极熔融电解法制备金属铝,其阴极反应式为___________。
(6)若用a吨该含铝废料通过上述流程,理论上可以生产铝___________吨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图两个装置中,液体体积均为200ml,开始时电解质溶液的浓度均为 0.1mol/L,工作一段时间后,测得导线上都通过了0.02mol电子,若不考虑溶液体积的变化,下列叙述正确的是( )

A. 产生气体体积①=②
B. 电极上析出固体质量①<②
C. 溶液的pH变化:①减小②增大
D. 电极反应式:①中阳极Cu2++2e-=Cu,②中负极Zn-2e-=Zn2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:

注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为_____________________。
(2)向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,溶液的pH_________ (填“增大”、“不变”或“减小”)。
(3)“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是___________。
(4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。阳极的电极反应式为_____________________,阴极产生的物质A的化学式为____________。
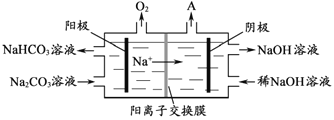
(5)铝粉在1000℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学”是当今社会提出的一个新概念。在“绿色化学”工艺中,理想状态是反应物中的原子全部转化为欲制的产物,即原子利用率为100%。下列反应最符合绿色化学中“原子经济”要求的是
A. nCH2=CH2![]()
![]()
B. CH4+2Cl2![]() CH2Cl2+2HCl
CH2Cl2+2HCl
C. Cl2+2NaOH===NaCl+NaClO+H2O
D. 3NO2+H2O===2HNO3+NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的量的计算是中学化学的重要内容,完成以下填空:
(1)0.5 L 1 mol/L CaCl2溶液中Ca2+的物质的量为_______,Cl的物质的量浓度为_______。
(2)标准状况下,33.6 L的HCl所具有的物质的量为______,将其溶解于水配成3 L的溶液,所得盐酸的物质的量浓度为______。
(3)8 g NaOH溶于______g水中,才能使每10个水分子中溶有一个钠离子。
(4)49 g H2SO4中含______mol原子,含______个质子。
(5)标准状况下,2.4 g某气体的体积为672 mL,则此气体的相对分子质量为_______。
(6)在同温、同压下,实验测得CO、N2和O2三种气体的混合气体的密度是H2的14.5倍,若其中CO和N2的物质的量之比为1∶1,则混合气体中氧元素的质量分数为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com