
【题目】下图两个装置中,液体体积均为200ml,开始时电解质溶液的浓度均为 0.1mol/L,工作一段时间后,测得导线上都通过了0.02mol电子,若不考虑溶液体积的变化,下列叙述正确的是( )

A. 产生气体体积①=②
B. 电极上析出固体质量①<②
C. 溶液的pH变化:①减小②增大
D. 电极反应式:①中阳极Cu2++2e-=Cu,②中负极Zn-2e-=Zn2+
【答案】C
【解析】
A、装置①属于电解池,阳极反应式为4OH--4e-=2H2O+O2↑,阴极反应式为Cu2++2e-=Cu,CuSO4的物质的量为200×10-3×0.1mol·L-1=0.02mol,当电路中通过0.02mol电子,消耗Cu2+物质的量为0.01mol,只有阳极产生气体,即产生氧气的物质的量为0.02/4mol=0.005mol,体积为0.112L,装置②为原电池,正极上的反应式为2H++2e-=H2↑,产生氢气的体积为0.02×22.4/2L=0.224L,①和②产生气体体积不相等,故A错误;B、装置②中没有固体析出,装置①有固体析出,因此电极上析出固体质量①>②,故B错误;C、装置①总电极反应式为2Cu2++2H2O![]() 2Cu+O2↑+4H+,溶液pH降低,装置②发生Zn+H2SO4=ZnSO4+H2↑,c(H+)降低,pH增大,故C正确;D、电极反应式:①中阳极上为4OH--4e-=2H2O+O2↑,②中负极反应式Zn-2e-=Zn2+,故D错误。
2Cu+O2↑+4H+,溶液pH降低,装置②发生Zn+H2SO4=ZnSO4+H2↑,c(H+)降低,pH增大,故C正确;D、电极反应式:①中阳极上为4OH--4e-=2H2O+O2↑,②中负极反应式Zn-2e-=Zn2+,故D错误。


科目:高中化学 来源: 题型:
【题目】某化合物6.4g在氧气中完全燃烧,只生成8.8g CO2和7.2 g H2O。下列说法正确的是
A. 该化合物仅含碳、氢两种元素 B. 该化合物中碳、氢原子个数比为1:4
C. 无法确定该化合物是否含有氧元素 D. 该化合物一定是C2H8O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量是高中化学常用的物理量,请完成以下有关计算。
(1)含0.4 mol Al3+的Al2(SO4)3中所含的SO42-的物质的量是___________。
(2)___________molH2O2所含原子数与0.2molH3PO4所含原子数相等。
(3)某硫酸钠溶液中含有3.01×1022个Na+,则溶液中SO42-的物质的量是___________。
(4)质量相同的H2、NH3、SO2、O3四种气体中,含有分子数目最少的是____________。
(5)现有mg某气体,它是三原子分子,其摩尔质量为Mg·mol-1。若阿伏加德罗常数用NA表示,请用以上符号及相应数字填写下列空格。
①该气体的物质的量为___________mol。
②该气体所含原子总数为___________个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学键的叙述正确的是
①化学键只存在于分子之间
②化学键是相邻原子之间强烈的相互作用
③化学键是一种静电作用
④化学键是相邻分子之间强烈的相互吸引
⑤离子化合物中可能含有共价键
⑥共价化合物中可能含有离子键
⑦离子化合物中只含离子键
⑧共价化合物中不含离子键
A.②③④⑦B.②③⑤⑧
C.②④⑤⑥D.①③⑤⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为使桥体更牢固,港珠澳大桥采用高性能绳索吊起,该绳索是超高分子量的聚乙烯材料,同时也使用了另一种叫芳纶(分子结构下图所示)的高性能材料,以下对这两种材料的说法错误的是
![]()
A. 芳纶是一种混合物
B. 聚乙烯能使溴水褪色
C. 聚乙烯和芳纶的废弃物在自然环境中降解速率慢,会造成环境压力
D. 合成芳纶的反应方程式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含有35.8g Na2CO3和NaHCO3混合物的溶液中加入200mL 某浓度的盐酸,恰好完全反应,生成8.96L CO2(标准状况)。问:
(1)原溶液中有__________mol Na2CO3,__________mol NaHCO3。
(2)盐酸的物质的量浓度_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇在工业中有广阔的用途
已知:①2CH3OH(l)+2O2(g)=2CO(g)+4H2O(l) △H=-a kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) △H=-b kJ·mol-1
(1)反应2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(1)的△H=___________。
(2)CH3OH不充分燃烧时,生成C、CO和CO2以及气态水,将所有的产物通入一个10L的密闭容器中,在一定条件下发生可逆反应:
CO(g)+ H2O(g)![]() CO2(g)+H2(g) △H>0
CO2(g)+H2(g) △H>0
①有利于提高CO平衡转化率的条件是___________。(填正确答案标号)
A.高温 B.低温 C.低压 D.高压
②下列事实能说明该反应达到平衡的是___________。(填正确答案标号)
A.体系中的颜色不发生变化 B. v正(CO)/v逆(H2)=1
C.c(CO)/c(H2)=1 D.CO2的浓度不再发生变化
③向该密闭容器中充入2 mol CO,4.8molH2O。在200℃下,20分钟后达到平衡,测得CO的转化率为60%,v(CO2)=___________;该温度下的平衡常数是___________。
(3)在加热条件下用甲醇气相法制备CO和H2时,常采用加NiO作催化剂。发生2CH3OH(l)![]() 2CO(g)+4H2(g) △H>0,日产量与温度的关系如图所示。
2CO(g)+4H2(g) △H>0,日产量与温度的关系如图所示。
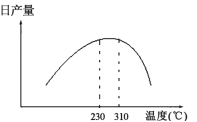
①保证较高日产量的适宜温度是______________;
②310℃以后日产量下降的原因可能是___________。
(4)21世纪甲醇燃料电池是最佳动力源之一。甲醇空气电池成为了车载电池,该燃料电池工作时的电池反应:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(1)。原理如图
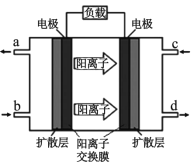
①c处应通入_________________________________;
②该电池的负极反应式为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛是一种重要的金属,以钛铁矿[主要成分为钛酸亚铁(FeTiO3),还含有少量Fe2O3]为原料制备钛的工艺流程如图所示。

(1)滤液1中钛元素以TiO2+形式存在,则“溶浸”过程发生的主要反应的化学方程式为________。
(2)物质A为________(填化学式),“一系列操作”为________。
(3)“水解”步骤中生成TiO2·xH2O,为提高TiO2·xH2O的产率,可采取的措施有________、________。(写出两条)。
(4)“电解”是以石墨为阳极,TiO2为阴极,熔融CaO为电解质。阴极的电极反应式为________;若制得金属Ti 9.60g,阳极产生气体________mL(标准状况下)。
(5)将少量FeSO4·7H2O溶于水,加入一定量的NaHCO3溶液,可制得FeCO3,写出反应的离子方程式________;若反应后的溶液中c(Fe2+)=2×10-6mol·L-1,则溶液中c(CO32-)=________mol·L-1。(已知:常温下FeCO3饱和溶液浓度为4.5×10-6mol·L-1)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com