
【题目】甲醇在工业中有广阔的用途
已知:①2CH3OH(l)+2O2(g)=2CO(g)+4H2O(l) △H=-a kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) △H=-b kJ·mol-1
(1)反应2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(1)的△H=___________。
(2)CH3OH不充分燃烧时,生成C、CO和CO2以及气态水,将所有的产物通入一个10L的密闭容器中,在一定条件下发生可逆反应:
CO(g)+ H2O(g)![]() CO2(g)+H2(g) △H>0
CO2(g)+H2(g) △H>0
①有利于提高CO平衡转化率的条件是___________。(填正确答案标号)
A.高温 B.低温 C.低压 D.高压
②下列事实能说明该反应达到平衡的是___________。(填正确答案标号)
A.体系中的颜色不发生变化 B. v正(CO)/v逆(H2)=1
C.c(CO)/c(H2)=1 D.CO2的浓度不再发生变化
③向该密闭容器中充入2 mol CO,4.8molH2O。在200℃下,20分钟后达到平衡,测得CO的转化率为60%,v(CO2)=___________;该温度下的平衡常数是___________。
(3)在加热条件下用甲醇气相法制备CO和H2时,常采用加NiO作催化剂。发生2CH3OH(l)![]() 2CO(g)+4H2(g) △H>0,日产量与温度的关系如图所示。
2CO(g)+4H2(g) △H>0,日产量与温度的关系如图所示。
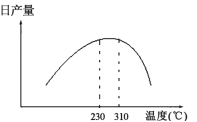
①保证较高日产量的适宜温度是______________;
②310℃以后日产量下降的原因可能是___________。
(4)21世纪甲醇燃料电池是最佳动力源之一。甲醇空气电池成为了车载电池,该燃料电池工作时的电池反应:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(1)。原理如图
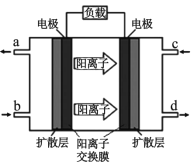
①c处应通入_________________________________;
②该电池的负极反应式为_________________________________。
【答案】—(a+b)kJ·mol-1 A BD 0.006mol/(L·min) 0.5 230~310℃ 催化剂活性降低或发生了副反应 氧气或空气 CH3OH—6e—+H2O = CO2↑+6H+
【解析】
(1)由盖斯定律计算可得;
(2)①该反应为气体体积不变的吸热反应,改变压强平衡不移动,升高温度,平衡向正反应方向移动;
②依据平衡时正反应速率等于逆反应速率,各物质浓度保持不变,以及衍生的物理量不变进行分析判断;
③依据题给数据建立三段式计算反应速率和平衡常数;
(4)由原理图中阳离子移动方向可知,左电极为负极,右电极为正极,酸性条件下,负极上CH3OH发生氧化反应生成二氧化碳,b处通入CH3OH,正极上氧气发生还原反应生成水,c处通入O2。
(1)由盖斯定律可知①+②得反应2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(1),则△H=△H1—△H2=—(a+b)kJ·mol-1,故答案为:—(a+b)kJ·mol-1;
(2)①该反应为气体体积不变的吸热反应,改变压强平衡不移动,升高温度,平衡向正反应方向移动,CO平衡转化率增大,故选A,故答案为:A;
②A、反应物和生成物都是无色气体,体系中的颜色不发生变化不能说明该反应达到平衡,错误;
B、v正(CO)/v逆(H2)=1说明正逆反应速率相等,说明该反应达到平衡,正确;
C、一定条件下可以达到c(CO)/c(H2)=1,但不能说明该反应达到平衡,错误;
D、达到化学平衡时,各物质浓度保持不变,则CO2的浓度不再发生变化说明该反应达到平衡,正确;
故选BD,故答案为:BD;
③20分钟后达到平衡,测得CO的转化率为60%,由题给数据建立如下三段式:
CO(g)+ H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
起(mol/L) 0.2 0.48 0 0
变(mol/L) 0.12 0.12 0.12 0.12
平(mol/L) 0.08 0.36 0.12 0.12
v(CO2)= 0.12mol/L/20min=0.006mol/(L·min);平衡常数K=c(CO2)c(H2)/c(CO)c(H2O)= (0.12mol/L×0.12mol/L)/( 0.08mol/L×0.36mol/L)=0.5,故答案为:0.006mol/(L·min);0.5;
(3)①由图可知230~310℃时,日产量较高,故答案为:230~310℃
②该反应为吸热反应,理论上,升高温度,平衡右移,日产量增大,由图可知,温度升高,日产量下降,可能是催化剂活性降低或发生了副反应,故答案为:催化剂活性降低或发生了副反应;
(4)由原理图中阳离子移动方向可知,左电极为负极,右电极为正极,酸性条件下,负极上CH3OH发生氧化反应生成二氧化碳,b处通入CH3OH,正极上氧气发生还原反应生成水,c处通入O2。
①由图可知,b处通入CH3OH,c处应通入O2,故答案为:氧气或空气;
②左电极为负极,负极上CH3OH发生氧化反应生成二氧化碳,电极反应式为CH3OH—6e—+H2O = CO2↑+6H+,故答案为:CH3OH—6e—+H2O = CO2↑+6H+。


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】氮族元素在化学领域具有重要的地位。请回答下列问题:
(1)基态氮原子的价电子轨道表示式为___________;第二周期的元素中,第一电离能介于B和N之间的元素有___________种。
(2)雌黄的分子式为As2S3,其分子结构如图所示:![]() As原子的杂化类型为___________。
As原子的杂化类型为___________。
(3)①向CuSO4溶液中加入少量氨水生成蓝色沉淀,继续加入氨水沉淀溶解,得到深蓝色透明溶液,向该溶液中加入一定量的乙醇,析出[Cu(NH3)4]SO4·H2O固体。SO42-的空间构型为___________;[Cu(NH3)4]SO4·H2O固体中含有的化学键有___________(填标号)。
A.离子键 B.共价键 C.氢键 D.金属键 E.配位键
若要确定[Cu(NH3)4]SO4·H2O是晶体还是非晶体,最科学的方法是进行___________实验。
②已知NF3与NH3分子的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,原因是___________。
(4)大π键可用![]() 表示,其中n、m分别代表参与形成大π键的原子个数和电子数,如苯分子中大π键表示为
表示,其中n、m分别代表参与形成大π键的原子个数和电子数,如苯分子中大π键表示为![]() 。N2O分子中的大π键表示为_________________。
。N2O分子中的大π键表示为_________________。
(5)立方氮化硼晶胞如图,其密度为ρg/cm3,氮化硼的摩尔质量为Mg/mol,阿伏加德罗常数的值为NA,硼原子的半径为r cm,则硼原子的空间占有率为____________________(用含有ρ、M、NA、r的代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡: ![]() ,
,![]() 。然后在恒定温度下缩小容器体积,重新达到平衡。下列分析正确的是
。然后在恒定温度下缩小容器体积,重新达到平衡。下列分析正确的是
A. 若![]() ,则该反应达到平衡状态
,则该反应达到平衡状态
B. 两次平衡时,后一次平衡时![]() 的浓度大
的浓度大
C. 重新达到平衡,密闭容器中氨气的体积分数不变
D. 若开始时向容器中加人2molNH3和1molCO2,则达到平衡时放出akJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图两个装置中,液体体积均为200ml,开始时电解质溶液的浓度均为 0.1mol/L,工作一段时间后,测得导线上都通过了0.02mol电子,若不考虑溶液体积的变化,下列叙述正确的是( )

A. 产生气体体积①=②
B. 电极上析出固体质量①<②
C. 溶液的pH变化:①减小②增大
D. 电极反应式:①中阳极Cu2++2e-=Cu,②中负极Zn-2e-=Zn2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:

注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为_____________________。
(2)向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,溶液的pH_________ (填“增大”、“不变”或“减小”)。
(3)“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是___________。
(4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。阳极的电极反应式为_____________________,阴极产生的物质A的化学式为____________。
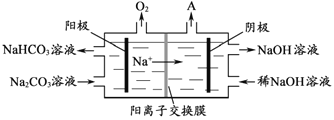
(5)铝粉在1000℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵(NH4)2Fe(SO4)2是一种重要的化学试剂。现有甲乙两个化学学习小组做了如下实验
Ⅰ.甲学习小组用图甲所示装置制备硫酸亚铁铵,所用药品有铁屑、稀硫酸、(NH4)2SO4溶液。
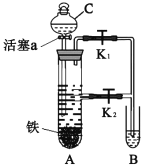
(1)装置C的名称是___________,(NH4)2SO4溶液在___________装置中(填“A”或“B”)。
(2)装置A中发生反应的化学方程式为___________。
(3)将B中的液体倒入蒸发皿蒸干时,往往先加入一定量的硫酸。其作用是在酸性条件下不易被氧化和___________。
(4)为防止B中制得的(NH4)2Fe(SO4)2被氧化变质,实验操作是___________。
Ⅱ.乙学习小组为了探究硫酸亚铁铵分解产物,査阅资料发现:硫酸亚铁铵隔绝空气加热到110℃左右完全分解。气体产物有N2、H2O、NH3和另一气体产物Ⅹ。该学习小组检验X气体的组成。
(5)该学习小组猜想X气体只有三种可能。分别是:i.SO2,ii.SO3,ⅲ.___________。
(6)该小组利用图乙装置进行检验。
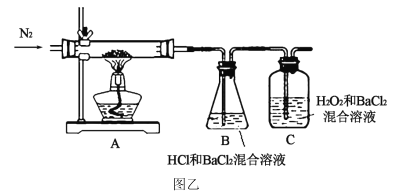
实验现象是B中未出现沉淀,C中溶液变浑浊。得出的结论是___________,C中发生反应的离子方程式是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学”是当今社会提出的一个新概念。在“绿色化学”工艺中,理想状态是反应物中的原子全部转化为欲制的产物,即原子利用率为100%。下列反应最符合绿色化学中“原子经济”要求的是
A. nCH2=CH2![]()
![]()
B. CH4+2Cl2![]() CH2Cl2+2HCl
CH2Cl2+2HCl
C. Cl2+2NaOH===NaCl+NaClO+H2O
D. 3NO2+H2O===2HNO3+NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
实验序号 | A溶液 | B溶液 |
① | 20mL 0.1mol·L-1H2C2O4溶液 | 30mL 0.1 mol·L-1KMnO4溶液 |
② | 20mL 0.2mol·L-1H2C2O4溶液 | 30mL 0.1mol·L-1KMnO4溶液 |
(1)该实验探究的是____因素对化学反应速率的影响。如图一,相同时间内针筒中所得的CO2体积大小关系是___(填实验序号)。

(2)若实验①在2min末收集了2.24mLCO2(标准状况下),则在2min末,c(MnO4-)___ mol·L-1(假设混合液体积为50mL)。
(3)除通过测定一定时间内CO2的体积来比较反应速率外,本实验还可通过测定___来比较化学反应速率。
(4)小组同学发现反应速率总是如图二,其中t1~t2时间内速率变快的主要原因可能是①产物MnSO4是该反应的催化剂、②_____。
Ⅱ.一定温度下,将一定量的N2和H2充入固定体积的密闭容器中进行反应:
N2(g)+3H2(g)![]() 2NH3(g)。
2NH3(g)。
(1)下列描述能说明该可逆反应达到化学平衡状态的有___。
A.容器内的压强不变
B.容器内气体的密度不变
C.相同时间内有3mol H-H键断裂,有6mol N-H键形成
D.c(N2):c(H2):c(NH3)=1:3:2
E.NH3的质量分数不再改变
(2)若起始时向容器中充入10mol ·L-1的N2和15mol ·L-1的H2,10min时测得容器内NH3的浓度为1.5mol ·L-1。10min内用N2表示的反应速率为___;此时H2的转化率为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是
A.若某共价化合物分子中只含C、N、H三种元素,且以n(C)和n(N)分别表示C和N的原子数目,则H原子数目最多为2n(C)+n(N)+2个
B.若某共价化合物分子中只含C、N、H、O四种元素,且以n(C)、n(N)和n(O)分别表示C、N和O的原子数目,则H原子数目最多等于2n(C)+ n(O)+n(N)+2个
C.在某有机物分子中含n个—CH2—,m个 ![]() ,a个—CH3,其余为羟基,则含羟基的个数最多为m—a+2
,a个—CH3,其余为羟基,则含羟基的个数最多为m—a+2
D.在有机物(![]() )分子中处于同一平面内的碳原子数最多有13个
)分子中处于同一平面内的碳原子数最多有13个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com