
����Ŀ�����������(NH4)2Fe(SO4)2��һ����Ҫ�Ļ�ѧ�Լ������м���������ѧѧϰС����������ʵ��
��.��ѧϰС����ͼ����ʾװ���Ʊ���������泥�����ҩƷ����м��ϡ���ᡢ(NH4)2SO4��Һ��
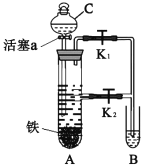
(1)װ��C��������___________��(NH4)2SO4��Һ��___________װ����(����A������B��)��
(2)װ��A�з�����Ӧ�Ļ�ѧ����ʽΪ___________��
(3)��B�е�Һ�嵹������������ʱ�������ȼ���һ���������ᡣ�������������������²��ױ�������___________��
(4)Ϊ��ֹB���Ƶõ�(NH4)2Fe(SO4)2���������ʣ�ʵ�������___________��
��.��ѧϰС��Ϊ��̽����������立ֽ����������Ϸ��֣���������笠����������ȵ�110��������ȫ�ֽ⡣���������N2��H2O��NH3����һ������������ѧϰС�����X�������ɡ�
(5)��ѧϰС�����X����ֻ�����ֿ��ܡ��ֱ��ǣ�i.SO2��ii.SO3����.___________��
(6)��С������ͼ��װ�ý��м��顣
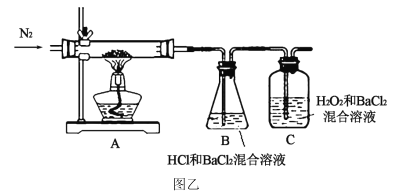
ʵ��������B��δ���ֳ�����C����Һ����ǡ��ó��Ľ�����___________��C�з�����Ӧ�����ӷ���ʽ��_________________________________��
���𰸡���Һ©�� B Fe+H2SO4�TFeSO4+H2�� ������������ˮ�� �ȴ�ֹˮ��K1���ٴ�Һ©����������a���μ�ϡ���ᣬ��B��ͨ������һ��ʱ��ر�ֹˮ��K1����K2,��Ӧ���ɵ�������������ѹ�����ɵ���������ѹ��Bװ�� SO2��SO3 X������SO2�����i.��ȷ SO2+H2O2+Ba2+= BaSO4��+2H+
��������
��.��ʵ��װ��ͼ��֪���Ʊ���������淋�ԭ��Ϊ���ȴ�ֹˮ��K1���ٴ�Һ©����������a������ϡ���ᷴӦ����������������������Ӧ���ɵ������ž�װ���еĿ�����ֹ����������������B��ͨ������һ��ʱ��ر�ֹˮ��K1����K2,��Ӧ���ɵ�������������ѹ�����ɵ���������ѹ��Bװ����������立�����Ӧ������������泥�
II.�����⣬��������笠����������ȵ�110��������ȫ�ֽ⣬���������N2˵����Ӧ��NԪ�ػ��ϼ����ߣ��ɴ˿�֪��Ӧ��SԪ�ػ��ϼ�һ�����ͣ���ԭ����һ��Ϊ��������
I.��1��װ��C�������Ƿ�Һ©�����������Һװ��װ��B�У��ʴ�Ϊ����Һ©����B��
��2��װ��A������ϡ���ᷴӦ����������������������Ӧ�Ļ�ѧ����ʽΪFe+H2SO4�TFeSO4+H2�����ʴ�Ϊ��Fe+H2SO4�TFeSO4+H2����
��3��B�е�Һ��Ϊ��������泥�Ϊ��ֹ�������ӱ��������Լ������������Ӻ�笠�����ˮ�⣬�������������Һ��������������ʱ��Ӧ�ȼ���һ���������ᣬ�����������Ӻ�笠�����ˮ�⣬�ʴ�Ϊ��������������ˮ�⣻
(4)Ϊ��ֹ�Ƶõ�(NH4)2Fe(SO4)2���������ʣ�Ӧ���γ������������������Ϊ���ȴ�ֹˮ��K1���ٴ�Һ©����������a������ϡ���ᷴӦ����������������������Ӧ���ɵ������ž�װ���еĿ�����ֹ����������������B��ͨ������һ��ʱ��ر�ֹˮ��K1����K2,��Ӧ���ɵ�������������ѹ�����ɵ���������ѹ��Bװ���У��ʴ�Ϊ���ȴ�ֹˮ��K1���ٴ�Һ©����������a���μ�ϡ���ᣬ��B��ͨ������һ��ʱ��ر�ֹˮ��K1����K2,��Ӧ���ɵ�������������ѹ�����ɵ���������ѹ��Bװ�ã�
��.��5�������⣬��������笠����������ȵ�110��������ȫ�ֽ⣬���������N2˵��NԪ�ػ��ϼ����ߣ��ɴ˿�֪��Ӧ��SԪ�ػ��ϼ�һ�����ͣ�X������һ���ж������������������ʴ�Ϊ��SO2��SO3��
��6��������ʵ��������B��δ���ֳ�����C����Һ����ǣ�˵��X���ж�������û����������C����Һ����ǵ�ԭ���Ƕ���������˫��ˮ��Ӧ�������ᣬ�������Ȼ�����Ӧ�������ᱵ��������Ӧ�Ļ�ѧ����ʽΪSO2+H2O2+Ba2+= BaSO4��+2H+���ʴ�Ϊ��X������SO2�����i.��ȷ��SO2+H2O2+Ba2+= BaSO4��+2H+��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��M�ǽ����������̵�ĸ߷����л��������ṹ��ʽΪ ����ʯ���ѽ����ϳ�M��·������
����ʯ���ѽ����ϳ�M��·������
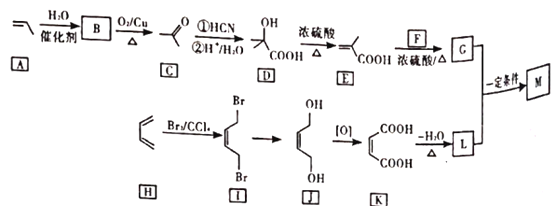
�ش��������⣺
(1)B�Ļ�ѧ����Ϊ___________��
(2)F�ķ���ʽΪ___________��
(3)G�й����ŵ�������___________��G��L��һ������������M�ķ�Ӧ������___________��
(4)I��J�ķ�Ӧ����ʽΪ___________��
(5)д��C��ͬ���칹��Ľṹ��ʽ(�˴Ź�������Ϊ����壬�������Ϊ3�U2�U1��______��
(6)����ɱ���ϩΪ��ʼԭ���Ʊ�![]() �ĺϳ�·��___________(���Լ���ѡ)��
�ĺϳ�·��___________(���Լ���ѡ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڻ�ѧ����������ȷ����
�ٻ�ѧ��ֻ�����ڷ���֮��
�ڻ�ѧ��������ԭ��֮��ǿ�ҵ������
�ۻ�ѧ����һ�־�������
�ܻ�ѧ�������ڷ���֮��ǿ�ҵ������
�����ӻ������п��ܺ��й��ۼ�
���ۻ������п��ܺ������Ӽ�
�����ӻ�������ֻ�����Ӽ�
��ۻ������в������Ӽ�
A.�ڢۢܢ�B.�ڢۢݢ�
C.�ڢܢݢ�D.�٢ۢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں���35.8g Na2CO3��NaHCO3��������Һ�м���200mL ijŨ�ȵ����ᣬǡ����ȫ��Ӧ������8.96L CO2(��״��)���ʣ�
(1)ԭ��Һ����__________mol Na2CO3��__________mol NaHCO3��
(2)��������ʵ���Ũ��_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״��ڹ�ҵ���й�������;
��֪����2CH3OH(l)+2O2(g)=2CO(g)+4H2O(l) ��H=��a kJ��mol��1
��2CO(g)+O2(g)=2CO2(g) ��H=��b kJ��mol��1
(1)��Ӧ2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(1)�ġ�H=___________��
(2)CH3OH�����ȼ��ʱ������C��CO��CO2�Լ���̬ˮ�������еIJ���ͨ��һ��10L���ܱ������У���һ�������·������淴Ӧ��
CO(g)+ H2O(g)![]() CO2(g)+H2(g) ��H>0
CO2(g)+H2(g) ��H>0
�����������COƽ��ת���ʵ�������___________��(����ȷ�𰸱��)
A.���� B.���� C.��ѹ D.��ѹ
��������ʵ��˵���÷�Ӧ�ﵽƽ�����___________��(����ȷ�𰸱��)
A.��ϵ�е���ɫ�������仯 B. v��(CO)/v��(H2)=1
C.c(CO)/c(H2)=1 D.CO2��Ũ�Ȳ��ٷ����仯
������ܱ������г���2 mol CO��4.8molH2O����200���£�20���Ӻ�ﵽƽ�⣬���CO��ת����Ϊ60%��v(CO2)=___________�����¶��µ�ƽ�ⳣ����___________��
(3)�ڼ����������ü״����෨�Ʊ�CO��H2ʱ�������ü�NiO������������2CH3OH(l)![]() 2CO(g)+4H2(g) ��H>0���ղ������¶ȵĹ�ϵ��ͼ��ʾ��
2CO(g)+4H2(g) ��H>0���ղ������¶ȵĹ�ϵ��ͼ��ʾ��
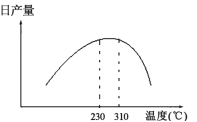
�ٱ�֤�ϸ��ղ����������¶���______________��
��310���Ժ��ղ����½���ԭ�������___________��
(4)21���ͼ״�ȼ�ϵ������Ѷ���Դ֮һ���״�������س�Ϊ�˳��ص�أ���ȼ�ϵ�ع���ʱ�ĵ�ط�Ӧ��2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(1)��ԭ����ͼ
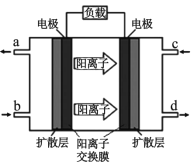
��c��Ӧͨ��_________________________________��
�ڸõ�صĸ�����ӦʽΪ_________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��µĶ��������У�������Ӧ��2A(g)��B(s)![]() C(g)��D(g)�������������ܱ�����Ӧ�Ѵﵽƽ��״̬���ǣ� ��
C(g)��D(g)�������������ܱ�����Ӧ�Ѵﵽƽ��״̬���ǣ� ��
�ٵ�λʱ��������n molC��ͬʱ����n mol D
�ڵ�λʱ��������n molD��ͬʱ����2n mol A
��C(g)�����ʵ���Ũ�Ȳ���
��������A��C��D���������Ũ��֮��Ϊ2��1��1
��v(A):v(C):v(D)=2��1��1
A. �ڢ� B. �ڢۢ� C. �ڢ� D. �ڢۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ����Ҫ�Ľ�������������[��Ҫ�ɷ�Ϊ����������FeTiO3��������������Fe2O3]Ϊԭ���Ʊ��ѵĹ���������ͼ��ʾ��

��1����Һ1����Ԫ����TiO2+��ʽ���ڣ����ܽ������̷�������Ҫ��Ӧ�Ļ�ѧ����ʽΪ________��
��2������AΪ________���ѧʽ������һϵ�в�����Ϊ________��
��3����ˮ�⡱����������TiO2��xH2O��Ϊ���TiO2��xH2O�IJ��ʣ��ɲ�ȡ�Ĵ�ʩ��________��________����д����������
��4������⡱����ʯīΪ������TiO2Ϊ����������CaOΪ����ʡ������ĵ缫��ӦʽΪ________�����Ƶý���Ti 9.60g��������������________mL����״���£���
��5��������FeSO4��7H2O����ˮ������һ������NaHCO3��Һ�����Ƶ�FeCO3��д����Ӧ�����ӷ���ʽ________������Ӧ�����Һ��c��Fe2+��=2��10-6mol��L-1������Һ��c��CO32-��=________mol��L-1������֪��������FeCO3������ҺŨ��Ϊ4.5��10-6mol��L-1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���W������������߷��Ӳ��Ϻϳɵ��м���ȣ��Ʊ�W��һ�ֺϳ�·�����¡�

��ش��������⣺
��1��F�Ļ�ѧ������________���ݵķ�Ӧ������________��
��2��E�к��еĹ�������________��д���ƣ���D�ۺ����ɸ߷��ӻ�����Ľṹ��ʽΪ________��
��3������Ӧ�۵õ��IJ�����O2�ڴ��������ȵ������·�Ӧ�ɵ�D��д����Ӧ�ܵĻ�ѧ����ʽ________��
��4���ܡ��������ܷ�ߵ���________����ܡ���������________��
��5����A���к�����ͬ�����ŵķ��㻯�����ͬ���칹�廹��________�֣����������칹�������к˴Ź�������Ϊ����壬�ҷ����֮��Ϊ1��1��2��2��2��2�Ľṹ��ʽΪ________��
��6�������л���W�������ϳ�·�ߣ���M��CH3ClΪԭ���Ʊ�F�ĺϳ�·�ߣ����Լ���ѡ��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1983�꣬���𱤴�ѧ�����ְͿˣ�Prinzbach�����ϳɶ�л����ӣ���ͼ���ӣ�������״����ʽ���pagoda��style temple�������Ը÷���Ҳ�ͳ�Ϊpagodane�������飩���йظ÷��ӵ�˵����ȷ���ǣ� ��
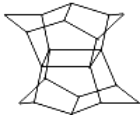
A. ����ʽΪC20H20
B. һ�ȴ����ͬ���칹��ֻ������
C. �����к��ж����Ǽ�����CH2����
D. �����к���4����Ԫ̼��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com