
【题目】氮族元素在化学领域具有重要的地位。请回答下列问题:
(1)基态氮原子的价电子轨道表示式为___________;第二周期的元素中,第一电离能介于B和N之间的元素有___________种。
(2)雌黄的分子式为As2S3,其分子结构如图所示:![]() As原子的杂化类型为___________。
As原子的杂化类型为___________。
(3)①向CuSO4溶液中加入少量氨水生成蓝色沉淀,继续加入氨水沉淀溶解,得到深蓝色透明溶液,向该溶液中加入一定量的乙醇,析出[Cu(NH3)4]SO4·H2O固体。SO42-的空间构型为___________;[Cu(NH3)4]SO4·H2O固体中含有的化学键有___________(填标号)。
A.离子键 B.共价键 C.氢键 D.金属键 E.配位键
若要确定[Cu(NH3)4]SO4·H2O是晶体还是非晶体,最科学的方法是进行___________实验。
②已知NF3与NH3分子的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,原因是___________。
(4)大π键可用![]() 表示,其中n、m分别代表参与形成大π键的原子个数和电子数,如苯分子中大π键表示为
表示,其中n、m分别代表参与形成大π键的原子个数和电子数,如苯分子中大π键表示为![]() 。N2O分子中的大π键表示为_________________。
。N2O分子中的大π键表示为_________________。
(5)立方氮化硼晶胞如图,其密度为ρg/cm3,氮化硼的摩尔质量为Mg/mol,阿伏加德罗常数的值为NA,硼原子的半径为r cm,则硼原子的空间占有率为____________________(用含有ρ、M、NA、r的代数式表示)。

【答案】![]() 3 sp3 正四面体形 ABE X射线衍射 F的电负性比N大,N-F成键电子对偏向F,导致NF3中N原子对其孤电子对的吸引能力增强,难以形成配位键
3 sp3 正四面体形 ABE X射线衍射 F的电负性比N大,N-F成键电子对偏向F,导致NF3中N原子对其孤电子对的吸引能力增强,难以形成配位键 ![]()
![]()
【解析】
(1)N是7号元素,最外层有5个电子,即价电子是5,基态氮原子的价电子轨道表示式为![]() ;一般情况下,同周期元素随原子序数增大,元素第一电离能呈增大趋势,ⅡA族、ⅤA族元素第一电离能高于同周期相邻元素的,第二周期第一电离能介于B和N之间的元素有Be、C、O 3种;
;一般情况下,同周期元素随原子序数增大,元素第一电离能呈增大趋势,ⅡA族、ⅤA族元素第一电离能高于同周期相邻元素的,第二周期第一电离能介于B和N之间的元素有Be、C、O 3种;
(2)雌黄的分子式为As2S3,在其分子结构每个As与3个S原子形成3个σ键、还含有1对孤电子对,杂化轨道数目为3+1=4,As杂化方式为sp3杂化;
(3)①SO42-的价电子对数=![]() ,形成四条杂化轨道,中心原子S原子的杂化方式为sp3,形成四面体结构,价电子对数=孤电子对数+配位原子数,可知孤电子对数为0,所以为正四面体结构;
,形成四条杂化轨道,中心原子S原子的杂化方式为sp3,形成四面体结构,价电子对数=孤电子对数+配位原子数,可知孤电子对数为0,所以为正四面体结构;
[Cu(NH3)4]SO4·H2O固体中內界离子遇外界离子间通过离子键结合;在配位体NH3、H2O分子内及SO42-中含有共价键;NH3与中心离子Cu2+间通过配位键结合,所以该晶体中含有的化学键有离子键、共价键、配位键,序号为ABE。
若要确定[Cu(NH3)4]SO4·H2O是晶体还是非晶体,最科学的方法是进行X射线衍射实验;
②已知NF3与NH3分子的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,这是由于F的电负性比N大,N-F成键电子对偏向F,导致NF3中N原子对其孤电子对的吸引能力增强,难以形成配位键;
(4)大π键可用![]() 表示,其中n、m分别代表参与形成大π键的原子个数和电子数,如苯分子中大π键表示为
表示,其中n、m分别代表参与形成大π键的原子个数和电子数,如苯分子中大π键表示为![]() 。N2O(与二氧化碳是等电子体)分子中的大π键表示为
。N2O(与二氧化碳是等电子体)分子中的大π键表示为![]() ;
;
(5)晶胞中B原子数目=4、N原子数目=8×![]() +6
+6![]() =4,二者原子数目之比为1:1,B原子配位数为4,则N原子配位数也是4。晶胞质量=
=4,二者原子数目之比为1:1,B原子配位数为4,则N原子配位数也是4。晶胞质量=![]() ,晶胞体积V==
,晶胞体积V==![]() =
=![]() cm3;晶胞内B原子的总体积=4×
cm3;晶胞内B原子的总体积=4×![]() cm3,所以硼原子的空间利用率=
cm3,所以硼原子的空间利用率=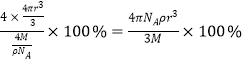 。
。


科目:高中化学 来源: 题型:
【题目】在100℃时,将0.2molN2O4(g)充入2L的恒容密闭容器中,间隔一定时间后对该容器内各物质的物质的量进行测定,得到如下数据:
时间/s | 0 | 20 | 40 | 60 | 80 |
N(N2O4)/mol | 0.20 | n1 | 0.10 | n3 | n4 |
N(NO2)/mol | 0.00 | 0.12 | n2 | 0.24 | 0.24 |
(1)该反应的平衡常数表达式为___________________________,由表中数据分析可得,n1=____mol,n3=________________mol;
(2)在上述条件下,从0到40s内NO2的平均反应速率为___________________;
(3)该反应达到化学平衡后,下列改变可使N2O4浓度增大的是_____(填序号);
A.增大容器的容积 B.向容器中充入一定量的NO2
C.向容器中再充入一定量的N2O4 D.向容器中充入一定量的He(g)
(4)在下图中画出此反应中N2O4的浓度随时间变化的曲线_________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】那可汀是一种药物,该药适用于刺激性干咳病人服用,无成瘾性。化合物I是制备该药物的重要中间体,合成路线如下:

(1)化合物A中的官能团名称为________________(写两种)。
(2)设计反应A→B的目的为________________________________。
(3)化合物C的分子式为C10H11O4I,写出C的结构简式:________________________。
(4)化合物I的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:____________________。
①分子中含有硝基(—NO2)且直接连在苯环上;②分子中只有3种不同化学环境的氢。
(5)写出以 和
和 为原料制备
为原料制备 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。____________
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物6.4g在氧气中完全燃烧,只生成8.8g CO2和7.2 g H2O。下列说法正确的是
A. 该化合物仅含碳、氢两种元素 B. 该化合物中碳、氢原子个数比为1:4
C. 无法确定该化合物是否含有氧元素 D. 该化合物一定是C2H8O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物。1,4-二氧杂螺[2.2]丙烷的结构简式为![]() 。下列说法正确的是
。下列说法正确的是
A. 1mol该有机物完全燃烧需要4molO2
B. 该有机物与 HCOOCH=CH2互为同分异构体
C. 该有机物的二氯代物有3种
D. 该有机物所有原子均处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M是降低润滑油凝固点的高分子有机化合物,其结构简式为 ,用石油裂解气合成M的路线如下
,用石油裂解气合成M的路线如下
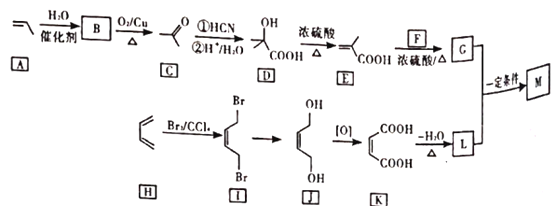
回答下列问题:
(1)B的化学名称为___________。
(2)F的分子式为___________。
(3)G中官能团的名称是___________,G与L在一定条件下生成M的反应类型是___________。
(4)I→J的反应方程式为___________。
(5)写出C的同分异构体的结构简式(核磁共振氢谱为三组峰,峰面积比为3︰2︰1)______。
(6)设计由苯乙烯为起始原料制备![]() 的合成路线___________(无机试剂任选)。
的合成路线___________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组的电极材料和电解液,不能组成原电池的是( )
A. 铜片、石墨棒,蔗糖溶液B. 锌片、石墨棒,硫酸铜溶液
C. 锌片、铜片,稀盐酸D. 铜片、银片,硝酸银溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量是高中化学常用的物理量,请完成以下有关计算。
(1)含0.4 mol Al3+的Al2(SO4)3中所含的SO42-的物质的量是___________。
(2)___________molH2O2所含原子数与0.2molH3PO4所含原子数相等。
(3)某硫酸钠溶液中含有3.01×1022个Na+,则溶液中SO42-的物质的量是___________。
(4)质量相同的H2、NH3、SO2、O3四种气体中,含有分子数目最少的是____________。
(5)现有mg某气体,它是三原子分子,其摩尔质量为Mg·mol-1。若阿伏加德罗常数用NA表示,请用以上符号及相应数字填写下列空格。
①该气体的物质的量为___________mol。
②该气体所含原子总数为___________个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇在工业中有广阔的用途
已知:①2CH3OH(l)+2O2(g)=2CO(g)+4H2O(l) △H=-a kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) △H=-b kJ·mol-1
(1)反应2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(1)的△H=___________。
(2)CH3OH不充分燃烧时,生成C、CO和CO2以及气态水,将所有的产物通入一个10L的密闭容器中,在一定条件下发生可逆反应:
CO(g)+ H2O(g)![]() CO2(g)+H2(g) △H>0
CO2(g)+H2(g) △H>0
①有利于提高CO平衡转化率的条件是___________。(填正确答案标号)
A.高温 B.低温 C.低压 D.高压
②下列事实能说明该反应达到平衡的是___________。(填正确答案标号)
A.体系中的颜色不发生变化 B. v正(CO)/v逆(H2)=1
C.c(CO)/c(H2)=1 D.CO2的浓度不再发生变化
③向该密闭容器中充入2 mol CO,4.8molH2O。在200℃下,20分钟后达到平衡,测得CO的转化率为60%,v(CO2)=___________;该温度下的平衡常数是___________。
(3)在加热条件下用甲醇气相法制备CO和H2时,常采用加NiO作催化剂。发生2CH3OH(l)![]() 2CO(g)+4H2(g) △H>0,日产量与温度的关系如图所示。
2CO(g)+4H2(g) △H>0,日产量与温度的关系如图所示。
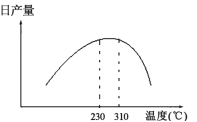
①保证较高日产量的适宜温度是______________;
②310℃以后日产量下降的原因可能是___________。
(4)21世纪甲醇燃料电池是最佳动力源之一。甲醇空气电池成为了车载电池,该燃料电池工作时的电池反应:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(1)。原理如图
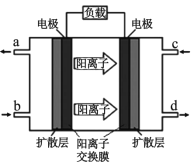
①c处应通入_________________________________;
②该电池的负极反应式为_________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com