
下列说法正确的是:
A.在100 ℃、101 kPa条件下,液态水的气化热为4 0.69 kJ·mol-1,则H2O(g)
0.69 kJ·mol-1,则H2O(g) H2O(l) 的ΔH = 40.69 kJ·mol-1
H2O(l) 的ΔH = 40.69 kJ·mol-1
B.已知MgCO3的Ksp = 6.82 × 10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+) = c(CO32-),且c(Mg2+) · c(CO32-) = 6.82 × 10-6
C.已知:
| 共价键 | C-C | C=C | C-H | H-H |
| 键能/ kJ·mol-1 | 348 | 610 | 413 | 436 |
则可以计算出反应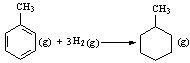 的ΔH为-384 kJ·mol-1
的ΔH为-384 kJ·mol-1
D.常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使NH3·H2O的电离度降低,溶液的pH减小
科目:高中化学 来源: 题型:
下列说法错误的是
A.钠在空气中燃烧最后所得产物为Na2O2
B.镁因在空气中形成了一薄层致密的氧化膜,保护了里面的镁,故镁不需要像钠似的进行特殊保护
C.铝制品在生活中非常普遍,这是因为铝不活泼
D.铁在潮湿的空气中因生成的氧化物很疏松,不能保护内层金属,故铁制品往往需涂保护层
查看答案和解析>>
科目:高中化学 来源: 题型:
煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g) CaO(s) + SO2(g) + CO2(g) ΔH1=218.4 kJ·mol-1(反应Ⅰ)
CaO(s) + SO2(g) + CO2(g) ΔH1=218.4 kJ·mol-1(反应Ⅰ)
CaSO4(s)+4CO(g) CaS(s) + 4CO2(g) ΔH2=-175.6 kJ·mol-1(反应Ⅱ)
CaS(s) + 4CO2(g) ΔH2=-175.6 kJ·mol-1(反应Ⅱ)
请回答下列问题:
(1)反应Ⅰ能够自发进行的反应条件是________。
(2)对于气体参与的反应,表示平衡常数Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量的浓度c(B),则反应Ⅱ的Kp=________(用表达式表示)。
(3)假设某温度下,反应Ⅰ的速率(v1 )大于反应Ⅱ的速率(v2 ),则下列反应过程能量变化示意图正确的是________。
(4)通过监测反应体系中气体浓度的变化可判断反应Ⅰ和Ⅱ是否同时发生,理由是____________________________________________________________________。
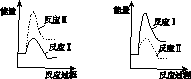
A B

C D
(5)图(a)为实验测得不同温度下反应体系中CO初始体积百分数与平衡时固体产物中CaS质量百分数的关系曲线。则降低该反应体系中SO2生成量的措施有________。
A.向该反应体系中投入石灰石
B.在合适的温度区间控制较低的反应温度
C.提高CO的初始体积百分数
D.提高反应体系的温度
(6)恒温恒容条件下,假设反应Ⅰ和Ⅱ同时发生,且v1>v2,请在图(b)画出反应体系中c(SO2)随时间t变化的总趋势图。

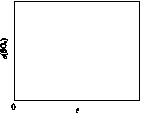
(a) (b)
查看答案和解析>>
科目:高中化学 来源: 题型:
某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO。其过程如下:
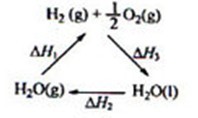
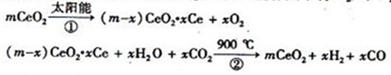
下列说法不正确的是( )
A.该过程中CeO2没有消耗
B.该过程实现了太阳能向化学能的转化
C.右图中△H1=△H2+△H3
D.以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH——2e—=CO32—+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
二甲醚(CH3OCH3)是无色气体,可作为一种新型能源,由合成气(组成为H2、CO、和少量CO2)直接制备二甲醚,其中主要过程包括以下四个反应:
甲醇合成反应:
①CO(g)+ 2H2(g)=CH3OH(g) △H1=-90.1 kJ·mol-1
②CO2(g)+ 3H2(g)=CH3OH(g)+H2O(g) △H2=-49.0 kJ·mol-1
水煤气变换反应:
③CO(g) + H2O (g)=CO2(g)+H2(g) △H3=-41.1 kJ·mol-1
二甲醚合成反应:
④2CH 3OH(g)=CH3OCH3(g)+H2O(g) △H4=-24.5 kJ·mol-1
3OH(g)=CH3OCH3(g)+H2O(g) △H4=-24.5 kJ·mol-1
⑴Al2O3是合成气直接制备二甲醚反应催化剂的主要成分之一。工业上从铝土矿制备较高纯度Al2O3的主要工艺流程是 (以化学方程式表示) 。
⑵分析二 甲醚合成反应④对于CO转化率的影响 。
甲醚合成反应④对于CO转化率的影响 。
⑶由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为 。
⑷有研究者在催化剂(含Cu-Zn-Al-O和Al2O3),压强为5.0MPa的条件下由H2和CO直接制备二甲醚,结果如下图所示。其中CO转化率随温度升高而降低的原因是____________。

⑸二甲醚直接燃料电池具有启动快,效率高等优点,其能量密度高于甲醇直接燃烧燃料电池(5.93kW·h·kg-1),若电解质为酸性,二甲醚直接燃料电池的负极反应为_______________。
一个二甲醚分子经过电化学氧化,可以产生_______个电子的电量;该电池理论输出电压1.20V,能量密度E=_____(列式计算,能量密度=电池输出电能/燃料质量,1kW·h=3.6×105J )
查看答案和解析>>
科目:高中化学 来源: 题型:
金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下密闭容器中用H2还原WO3可得到金属钨,其总反应为: WO3(s)+3H2(g)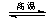 W (s) +3H2O (g)
W (s) +3H2O (g)
请回答下列问题:
⑴上述反应的化学平衡常数表达式为 。
⑵某温度下反应达到平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转 化率为 ;随着温度的升高,H2与水蒸气的体积比减小,则该反应为 反应(填“吸热”或“放热”)。
化率为 ;随着温度的升高,H2与水蒸气的体积比减小,则该反应为 反应(填“吸热”或“放热”)。
⑶上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
| 温度 | 25 ℃~550 ℃~600 ℃~700 ℃ |
| 主要成分 | WO3 W2O5 WO2 W |
第一阶段反应的化学方程式为 ;580 ℃时,固体物质的主要成分为 ;假设WO3完全转化为W,则三个阶段消耗H2物质的量之比为  。
。
⑷已知:温度过高时,WO2(s)转变为WO2(g):
WO2(s)+2H2(g)  W(s)+2H2O (g) ∆H=+66.0 kJ/mol
W(s)+2H2O (g) ∆H=+66.0 kJ/mol
WO2(g)+2H2(g)  W(s)+2H2O (g) ∆H=-137.9 kJ/mol
W(s)+2H2O (g) ∆H=-137.9 kJ/mol
则WO2(s)  WO2(g)的∆H= 。
WO2(g)的∆H= 。
⑸钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W(s)+ 2 I2 (g) 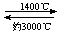 WI4 (g)。下列说法正确的有 。
WI4 (g)。下列说法正确的有 。
a.灯管内的I2可循环使用
b.WI4在灯丝上分解,产生的W又沉积在灯丝上
c.WI4在灯管壁上分解,使灯管的寿命延长
d.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢
查看答案和解析>>
科目:高中化学 来源: 题型:
某反应的△H=+100kJ·mol-1,下列有关该反应的叙述正确的是
A.正反应活化能小于100kJ·mol-1
B.逆反应活化能一定小于100kJ·mol-1
C.正反应活化能不小于100kJ·mol-1
D.正反应活化能比逆反应活化能大100kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下表列出了3种燃煤烟气脱硫方法的原理。
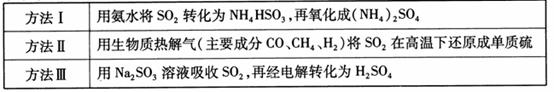
(1) 方法Ⅰ中氨水吸收燃煤烟气中 的化学反应为:
的化学反应为:
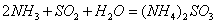

能提高燃煤烟气中 去除率的措施有 ▲ (填字母)。
去除率的措施有 ▲ (填字母)。
A.增大氨水浓度
B.升高反应温度
C.使燃煤烟气与氨水充分接触
D. 通入空气使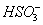 转化为
转化为
采用方法Ⅰ脱硫,并不需要预先除去燃煤烟气中大量的 ,原因是▲(用离子方程式表示)。
,原因是▲(用离子方程式表示)。
(2) 方法Ⅱ重要发生了下列反应:
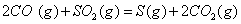
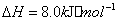


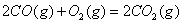
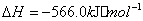



 与
与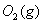 反应生成
反应生成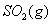 的热化学方程式为 。
的热化学方程式为 。
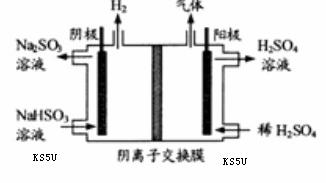
(3) 方法Ⅲ中用惰性电极电解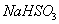 溶液的装置
溶液的装置
如右图所示。阳极区放出气体的成分为 。
(填化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.SiH4比CH4稳定
B.O2―半径比F―的小
C.Na和Cs属于第ⅠA族元素,Cs失电子能力比Na的强
D.P和As属于第ⅤA族元素,H3PO4酸性比H3AsO4的弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com