
| V |
| Vm |
| 2.24 |
| 22.4 |
| ||
| V |
| Vm |
| 2.24 |
| 22.4 |
| ||
| ||
| 0.2 |
| 0.2 |


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| NaNO2 |
| ①O3 |
| ②Zn/H2O |
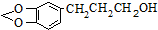 是一种合成药物的中间体,以CH2(COOH)2、CH2Cl2 及
是一种合成药物的中间体,以CH2(COOH)2、CH2Cl2 及 (无机试剂任用)为原料制备该化合物,请将合成该化合物路线流程图补充完整.
(无机试剂任用)为原料制备该化合物,请将合成该化合物路线流程图补充完整.| 反应试剂 |
| 反应条件 |
| 反应试剂 |
| 反应条件 |
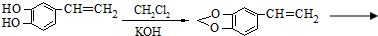
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去乙酸乙酯中混有的少量乙酸:加入饱和碳酸钠溶液,振荡、静置、分液 |
| B、除去乙醇中混有的少量水:加入适量的金属钠,充分反应后蒸馏 |
| C、除去溴苯中混有的少量溴:加入足量的氢氧化钠溶液,振荡、静置、分液 |
| D、除去96%的乙醇中的少量水制无水乙醇:加入生石灰,振荡、静置、蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化钠和氯化镁溶液分别与硝酸银溶液混合都能产生白色沉淀 |
| B、浓硫酸和稀盐酸长期暴露在空气中浓度降低 |
| C、氯水和活性炭使红墨水褪色 |
| D、漂白粉和水玻璃长期暴露在空气中变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 邻苯二甲酸氢钾的质量(g) | 待测NaOH溶液的体积(mL) |
| 1 | 0.612 | 21.20 |
| 2 | 0.612 | 20.10 |
| 3 | 0.612 | 19.90 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | A | B | C |
| 发生装置 |  |  | 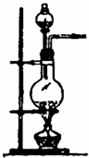 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数Kc | 9.94 | 9 | 1 |
| A | B | C | D | E | |
| n(CO2) | 3 | 1 | 0 | 1 | 1 |
| n(H2) | 2 | 1 | 0 | 1 | 2 |
| n(CO) | 1 | 2 | 3 | 0.5 | 3 |
| n(H2O) | 5 | 2 | 3 | 2 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2Mg十O2=2MgO |
| B、C十H2O=CO十H2 |
| C、HCl十NaOH=NaCl十H2O |
| D、CaO十H2O=Ca(OH)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com