
| ||
| a |
| 65b |
| 22.4a |
| 65b |
| 22.4a |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
A、该溶液中
| ||
| B、等物质的量浓度、等体积HX溶液和氨水混合,混合液一定呈中性 | ||
| C、等体积的pH=11的NaOH溶液和pH=3的HX的溶液混合,溶液呈酸性 | ||
| D、在HX溶液中滴加烧碱溶液,可能存在:c(Na+)>c(OH-)>c(X-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
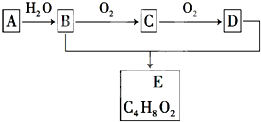 有机化合物A只由C、H两种元素组成且能使溴水褪色,其产量可以用来衡量一个国家石油化学工业的发展水平.A、B、C、D、E有如图所示的关系.则下列推断不正确的是( )
有机化合物A只由C、H两种元素组成且能使溴水褪色,其产量可以用来衡量一个国家石油化学工业的发展水平.A、B、C、D、E有如图所示的关系.则下列推断不正确的是( )| A、鉴别A和甲烷可选择酸性高锰酸钾溶液 | ||
| B、B、D均既能与金属钠反应也能与NaHCO3反应 | ||
| C、物质C的结构简式为CH3CHO | ||
D、B+D→E的化学方程式为CH3CH2OH+CH3COOH
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| ①试剂X |
| ②10%H2O |
| PH=5.5 |
| ③试剂Y |
| ④Na2CO3 |
| ⑤洗涤 |
| 焙烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:
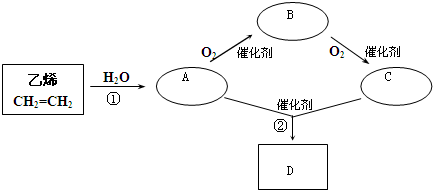
查看答案和解析>>
科目:高中化学 来源: 题型:
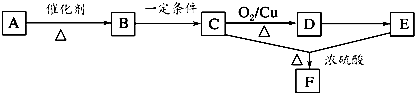
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
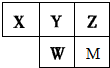
| A、原子半径大小:r(X)>r(Y)>r(W)>r(Z) |
| B、甲物质由M和Z元素组成,溶于水后一定得到甲的水溶液 |
| C、氢化物的稳定性:X>Y;氧化物水化物的酸性:W>Y>M |
| D、Y的气态氢化物(YH3)的空间结构为三角锥形 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com