
【题目】下列有机化学反应方程式的书写及反应类型判断都正确的是
A. CH3CH2OH +Na→CH3CH2ONa + H2↑ 置换反应
B. CH2=CH2+Br2→CH2BrCH2Br 加成反应
C. ![]() 氧化反应
氧化反应
D. C2H6+Cl2 →C2H4Cl2+H2 取代反应
 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.1molCl2和足量的铁加热条件下反应,转移电子数一定为3NA
B.常温常压下,8.8g CO2和N2O的混合气体所含电子数为4.4 NA
C.常温下,PH=13的Ba(OH)2 溶液,0.1L,含OH﹣ , 0.02NA
D.1 L 1 mol/L的乙醇水溶液中含有氢原子总数为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香化合物M的结构简式为 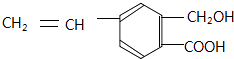 ,关于有机物M的说法正确的是( )
,关于有机物M的说法正确的是( )
A.有机物M中含有四种官能团
B.1 molNa2CO3最多能消耗1 mol有机物M
C.1 mol M和足量金属钠反应生成22.4 L气体
D.有机物M能发生取代、氧化和加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2 L恒容密闭容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图所示,反应在t1 min 时达到平衡。
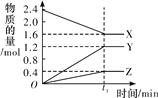
(1)请写出该反应的化学方程式:_____________________________。
(2)若上述反应中X、Y、Z分别为NH3、H2、N2,且已知1 mol 氨气分解成氮气和氢气要吸收46 kJ的热量,则至t1 min时,该反应吸收的热量为________;在此t1 min时间内,用H2表示该反应的平均速率v(H2)为__________。下列叙述能判断该反应达到平衡状态的是________(填字母代号)。
A.容器内各气体组分的质量分数不再发生改变
B.正反应速率与逆反应速率相等
C.容器内气体的密度不再发生改变
D.混合气体的平均相对分子质量不再发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定已部分变质的过氧化钠样品的纯度,设计如图所示的实验装置,图中Q为弹性良好的气球(不与药品反应),称取一定量的样品放入其中.按如图所示的装置安装好仪器,打开分液漏斗的活塞,将稀硫酸滴入气球中. 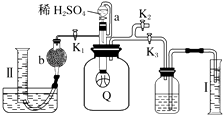
请回答下列问题:
(1)Q内发生反应生成种气体,其中的反应有个为氧化还原反应.
(2)为测定反应时生成气体的总体积,滴稀H2SO4前必须关闭(填“K1”、“K2”或“K3”),打开(填“K1”、“K2”或“K3”).
(3)当上述反应停止时,将K1、K2、K3均关闭,然后先打开K2 , 再缓缓打开K1 , 这时可观察到的现象是 .
(4)b中装的固体试剂是 , 需缓缓打开K1的原因为 .
(5)实验结束时,量筒Ⅰ中有x mL水,量筒Ⅱ中收集到y mL气体,则过氧化钠的纯度是(用含x、y的式子表示,上述体积均已折算成标准状况).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。某厂为了变废为宝,将工业废水(含5.00×10-3 mol·L-1的Cr2O72-)处理得到磁性材料Cr0.5Fe1.5FeO4,设计了如下实验流程:
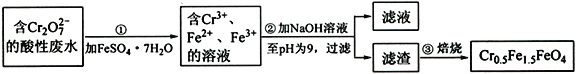
(1)第①步反应的离子方程式是________________________________。
(2)第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有____________________。
(3)为保证磁性材料的质量,应控制第①步反应后所得溶液中Fe2+与Fe3+的比例为______________。在第②步过程中,须持续通入N2,原因是________________________________。
(4)将FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的浊液。浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是________________________________。
(5)某研究性学习小组欲从蚀刻镀铜电路板所得废液(溶质为FeCl2、CuCl2、FeCl3)出发,制备FeCl3·6H2O,请设计制取FeCl3·6H2O的实验步骤:___________________________。 (可选用的试剂:铁粉、盐酸和H2O2溶液)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.1molN2中含有的分子数为2×6.02×1023
B.用激光笔照射CuSO4溶液可产生“丁达尔效应”
C.常温下,铝片能溶于浓硫酸
D.常温下,淀粉溶液遇I2变为蓝色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨为重要化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a.CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H=+216.4kJ/mol
CO(g)+3H2(g) △H=+216.4kJ/mol
b.CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-41.2kJ/mol
CO2(g)+H2(g) △H=-41.2kJ/mol
则反应CH4(g)+2H2O(g)![]() CO2(g)+4H2(g) △H=_________。
CO2(g)+4H2(g) △H=_________。
(2)起始时投入氮气和氢气分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度关系如下图。
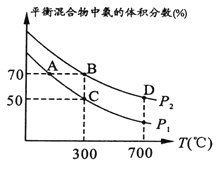
①恒压时,反应一定达到平衡状态的标志是______(填序号);
A.N2和H2的转化率相等 B.反应体系密度保持不变
C. ![]() 比值保持不变 D.
比值保持不变 D. ![]() =2
=2
②P1_____P2(填“>”、“<”、“=”、“不确定”,下同);反应平衡常数:B点____D点;
③C点H2的转化率____;在A、B两点条件下,该反应从开始到平衡时生成氨气平均速率:v(A)______v(B)。
(3)N2H4可作火箭推进剂,NH3和NaClO在一定条件下反应可生成N2H4。
①写出NH3和NaClO反应生成N2H4的化学方程式__________;
②已知25℃时N2H4水溶液呈弱碱性:N2H4+H2O![]() N2H5++OH- K1=1×10-a;N2H5++H2O
N2H5++OH- K1=1×10-a;N2H5++H2O![]() N2H62++OH- K2=1×10-b。
N2H62++OH- K2=1×10-b。
25℃时,向N2H4水溶液中加入H2SO4,欲使c(N2H5+)>c(N2H4),同时c(N2H5+)>c(N2H62+),应控制溶液pH范围_________(用含a、b式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列应用不涉及氧化还原反应的是( )
A. Na2O2用作呼吸面具的供氧剂 B. 工业上电解熔融状态的Al2O3制备Al
C. 工业上利用合成氨实现人工固氮 D. 实验室用NH4Cl和Ca(OH)2制备NH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com