
【题目】为了测定已部分变质的过氧化钠样品的纯度,设计如图所示的实验装置,图中Q为弹性良好的气球(不与药品反应),称取一定量的样品放入其中.按如图所示的装置安装好仪器,打开分液漏斗的活塞,将稀硫酸滴入气球中. 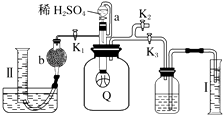
请回答下列问题:
(1)Q内发生反应生成种气体,其中的反应有个为氧化还原反应.
(2)为测定反应时生成气体的总体积,滴稀H2SO4前必须关闭(填“K1”、“K2”或“K3”),打开(填“K1”、“K2”或“K3”).
(3)当上述反应停止时,将K1、K2、K3均关闭,然后先打开K2 , 再缓缓打开K1 , 这时可观察到的现象是 .
(4)b中装的固体试剂是 , 需缓缓打开K1的原因为 .
(5)实验结束时,量筒Ⅰ中有x mL水,量筒Ⅱ中收集到y mL气体,则过氧化钠的纯度是(用含x、y的式子表示,上述体积均已折算成标准状况).
【答案】
(1)2;1
(2)K1、K2;K3
(3)气球Q慢慢缩小
(4)碱石灰;控制气体流速,使CO2充分吸收
(5)![]()
【解析】解:(1.)变质的过氧化钠中含有碳酸钠,加入酸后Q内发生反应:2Na2O2+2H2SO4=2Na2SO4+2H2O+O2↑;Na2CO3+H2SO4=Na2SO4+H2O+CO2↑,前者的氧元素的化合价发生了变化,是氧化还原反应,后者元素的化合价未变,是非氧化还原反应,
故答案为:2;1;
(2.)反应产生的CO2、O2使气球变大,将广口瓶中气体排出,水进入量筒Ⅰ中,所以量筒Ⅰ中水的体积即为产生的CO2、O2的体积,所以滴稀H2SO4前必须关闭K1、K2打开K3 , 故答案为:K1、K2;K3;
(3.)反应停止,打开K2 , 再缓缓打开K1 , 广口瓶内外相通,气球Q慢慢缩小,故答案为:气球Q慢慢缩小;
(4.)混合气体通过碱石灰吸收CO2 , 最后量筒Ⅱ中收集的是O2 , 故答案为:碱石灰;控制气体流速,使CO2充分吸收;
(5.)
2Na2O2 | + | 2H2SO4 | = | 2Na2SO4 | + | 2H2O | + | O2↑ |
|
|
Na2CO3 | + | H2SO4 | = | Na2SO4 | + | H2O | + | CO2↑ |
|
|
则过氧化钠的质量为: ![]() ×2×78,碳酸钠的质量为:
×2×78,碳酸钠的质量为: ![]() ×106,
×106,
所以过氧化钠的纯度: ![]() =
= ![]() ,故答案为:
,故答案为: ![]() .
.
2Na2O2+2H2SO4=2Na2SO4+2H2O+O2↑;Na2CO3+H2SO4=Na2SO4+H2O+CO2↑,根据化合价变化判断氧化还原反应;(2)反应产生的CO2、O2使气球变大,将广口瓶中气体排出,水进入量筒Ⅰ中,所以量筒Ⅰ中水的体积即为产生的CO2、O2
的体积;(3)反应停止,打开K2 , 再缓缓打开K1 , 广口瓶内外相通,气球Q慢慢缩小;(4)混合气体通过碱石灰吸收CO2 , 最后量筒Ⅱ中收集的是O2;(5)根据化学方程式计算出碳酸钠、过氧化钠的质量并过氧化钠的纯度.
(1)变质的过氧化钠中含有碳酸钠,加入酸后Q内发生反应:


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】水能灭火也可以引火.把少量过氧化钠(Na2O2)粉末用干燥脱脂棉包裹(脱脂棉和过氧化钠不反应),将少量水滴到包有过氧化钠的脱脂棉上,则脱脂棉迅速发生燃烧.小明对此现象很感兴趣,于是他和同学们进行如下探究:
【提出问题】过氧化钠与水反应生成了什么物质?为什么脱脂棉会燃烧?
【猜想】
①可能有一种气体和另一种物质生成.
②反应过程中可能有能量变化.
【设计实验】如图所示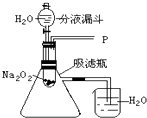
实验一:探究反应后生成的气体是什么?
(1)打开如图装置中的分液漏斗的活塞,控制滴加水的速度,观察到试管内有气泡产生,用带火星的木条靠近P处,木条复燃,说明生成的气体是 . 发生的反应方程式为其中氧化剂为;还原剂为;产生0.2mol的氧气,需要的转移电子mol.
(2)实验中,还观察到伸入烧杯中的导管口有气泡冒出,请解释产生该现象的原因: .
(3)实验二:继续探究反应后生成的另一种物质是什么?
小强猜想另一种物质是Na2CO3 , 小明认为不可能,小明的依据是 .
(4)为了证实小明的看法,请你设计一个证明CO32﹣不存在的实验.
实验步骤 | 实验现象 | 实验结论 |
(5)小明取反应后所得的溶液于试管中,滴入无色酚酞试液,发现酚酞试液变红色,说明反应后所得的另一种物质是(填化学式).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学反应中,设反应物的总能量为E1,生成物的总能量为E2。
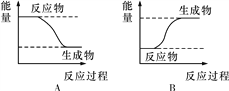
(1)若E1>E2,则该反应为________(填“放热”或“吸热”)反应。该反应可用图________(填“A”或“B”)表示。
(2)若E1<E2,则该反应为________(填“放热”或“吸热”)反应。该反应可用图________(填“A”或“B”)表示。
(3)太阳能的开发和利用是21世纪的一个重要课题。
①利用储能介质储存太阳能的原理是白天在太阳照射下,某种盐熔化,吸收热量;晚间熔盐释放出相应能量,从而使室温得以调节。已知下列数据:
盐 | 熔点/℃ | 熔化吸热/kJ·mol-1 | 参考价格/元·kg-1 |
CaCl2·6H2O | 29.0 | 37.3 | 780~850 |
Na2SO4·10H2O | 32.4 | 77.0 | 800~900 |
Na2HPO4·12H2O | 36.1 | 100.1 | 1 600~2 000 |
Na2S2O3·5H2O | 48.5 | 49.7 | 1 400~1 800 |
其中最适宜作储能介质的是________(填字母代号)。
A.CaCl2·6H2O B.Na2SO4·10H2O
C.Na2HPO4·12H2O D.Na2S2O3·5H2O
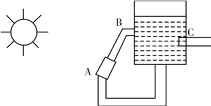
②下图是一种太阳能热水器的示意图,图中A是集热器,B是储水容器,C是供阴天时加热的辅助电热器。根据对水的密度的认识,你估计在阳光照射下水将沿________(填“顺”或“逆”)时针方向流动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨浸菱锌矿制备活性氧化锌,成本低,选择性好,其工艺流程如下:
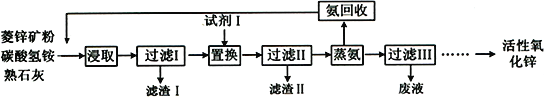
(1)滤渣Ⅰ主要成分的化学式为__________。
(2)浸取液中含少量Pb2+、Cu2+等重金属离子,可加入试剂Ⅰ除去,试剂Ⅰ为______________,但在实际操作过程中实际加入量远高于理论量,可能的原因是____________________________。
(3)过滤Ⅱ后得到Zn(NH3)4CO3溶液,经直接蒸汽加热可析出碱式碳酸锌[ZnCO3·2Zn(OH)2·H2O]沉淀,其反应化学方程式为____________________________。
(4)蒸氨过程中会有部分氨气逸出,可用电化学气敏传感器监测环境中NH3的含量,原理如图所示。负极的电极反应为________________________________,假设蒸氨过程中逸出氨气16.8L (标准状况)进入传感器,另一极需要通入标准状况下O2的体积为____________________。
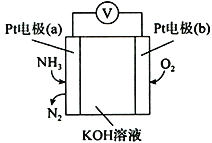
(5)蒸氨完成时,废液中残余氨含量需小于0.2mol/L,如果残余氨浓度过低,蒸汽用量增大,回收氨水中氨浓度降低,不利于循环使用;如果残余氨浓度过高,会导致____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机化学反应方程式的书写及反应类型判断都正确的是
A. CH3CH2OH +Na→CH3CH2ONa + H2↑ 置换反应
B. CH2=CH2+Br2→CH2BrCH2Br 加成反应
C. ![]() 氧化反应
氧化反应
D. C2H6+Cl2 →C2H4Cl2+H2 取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应:KIO3+6HI===3I2+KI+3H2O中,氧化产物与还原产物的物质的量之比为( )
A. 1∶1 B. 6∶1
C. 1∶5 D. 5∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.甲烷与氯气发生置换反应生成一氯甲烷、二氯甲烷等
B.乙烯不能使酸性KMnO4溶液褪色
C.溴水与乙炔发生化合反应而褪色
D.苯不能与溴水发生加成反应说明苯分子中的碳碳键不是单双键交替
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com