
【题目】等质量的两份铝分别与足量的HCl与NaOH溶液充分反应后所得相同条件气体的体积比
A. 1﹕2 B. 1﹕3 C. 1﹕1 D. 3﹕1
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】将适量铁粉放入FeCl3溶液中,完全反应后,溶液中的Fe2+和Fe3+浓度相等,则已反应的Fe3+和未反应的Fe3+的物质的量之比是( )
A. 2∶3 B. 3∶2
C. 1∶2 D. 1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量浓度相同的CH3COOH和NaOH溶液混合后,溶液中c(CH3COO﹣)=c(Na+),则醋酸体积氢氧化钠溶液体积(填“>”或“=”或“<”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下表中的信息分析回答问题:
元素 | 元素或由元素组成的物质性质 |
A | 单质在自然界中硬度最大,燃烧产生的气体能使澄清石灰水变浑浊。 |
B | 原子最外层电子数是次外层电子数三倍 |
C | 金属焰色反应为黄色,与氧气燃烧生成淡黄色固体 |
D | 单质在空气中体积分数最大 |
E | 固体为淡黄色,燃烧产生气体有漂白性。 |
F | 相同条件下气体密度最小 |
(1)用电子式写出形成F2E的过程__________________;
(2)写出CBF物质的电子式______________;
(3)C2B2物质中存在化学键的类型是___________ ,1 molC2B2与足量AB2反应转移的电子数为_______;
(4)由B、C、E形成的简单离子半径由大到小的关系是______________(用离子符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.1molCl2和足量的铁加热条件下反应,转移电子数一定为3NA
B.常温常压下,8.8g CO2和N2O的混合气体所含电子数为4.4 NA
C.常温下,PH=13的Ba(OH)2 溶液,0.1L,含OH﹣ , 0.02NA
D.1 L 1 mol/L的乙醇水溶液中含有氢原子总数为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】直接排放含SO2会形成酸雨,危害环境。某化学实验小组用如下装置进行有关SO2性质的探究活动。
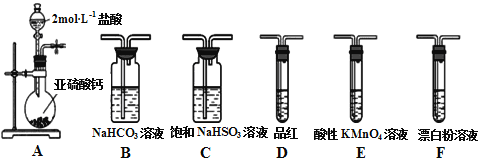
(1)装置A中反应的离子方程式为___________________________________。
(2)选用以上装置和药品探究亚硫酸与次氯酸的酸性强弱:甲同学认为按照A→C→F→尾气处理顺序连接装置可以证明,乙同学认为该方案不合理,其理由是___________________。正确的连接顺序是:A→C→___________→尾气处理(填字母)顺序连接装置。证明亚硫酸的酸性强于次氯酸的酸性的实验现象是__________________________。
(3)将二氧化硫通入以下装置可以制备Na2S2O3:

①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是________________。
②写出装置A中发生反应的化学方程式___________________________________。
③Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下:
第一步:准确称取a g KIO3(化学式量:214)固体配成溶液;
第二步:加入过量KI固体和H2SO4溶液,滴加指示剂;
第三步:用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液的体积为V mL。则c(Na2S2O3)=____mol·L-1。(已知:IO3-+5I-+6H+= 3I2+3H2O, 2S2O32-+I2=S4O62-+2I-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温下乙醛的沸点为20.8℃,且与水互溶.用HgSO4做催化剂,在75℃左右,乙炔可水化为乙醛,但HgSO4遇到某些特定物质常会发生催化剂中毒而失去催化作用,H2S就是其中一种:现用乙炔水化法,只用块状电石、浓硫酸、水、NaOH溶液、HgO粉末五种物质制取乙醛,装置如图所示,请回答下列问题; 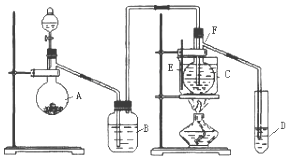
(1)实验开始时,仪器A中盛放电石,B中装NaOH溶液,其作用是 .
(2)仪器D中盛放水,其作用是吸收蒸气.
(3)蒸馏烧瓶F中应加入HgO和浓硫酸、水两种试剂,若将三者分别直接加入,请按加入的先后顺序写出包括HgO在内的各试剂的名称:氧化汞→→ .
(4)装置图中,加热F的方法叫 , 所选用温度计F的量程表示正确的是(填代号). A.0℃~50℃B.0℃~100℃C.0℃~200℃D. 0℃~360℃
(5)检验乙醛已制出的操作及现象是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定已部分变质的过氧化钠样品的纯度,设计如图所示的实验装置,图中Q为弹性良好的气球(不与药品反应),称取一定量的样品放入其中.按如图所示的装置安装好仪器,打开分液漏斗的活塞,将稀硫酸滴入气球中. 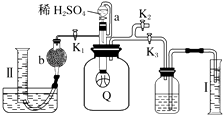
请回答下列问题:
(1)Q内发生反应生成种气体,其中的反应有个为氧化还原反应.
(2)为测定反应时生成气体的总体积,滴稀H2SO4前必须关闭(填“K1”、“K2”或“K3”),打开(填“K1”、“K2”或“K3”).
(3)当上述反应停止时,将K1、K2、K3均关闭,然后先打开K2 , 再缓缓打开K1 , 这时可观察到的现象是 .
(4)b中装的固体试剂是 , 需缓缓打开K1的原因为 .
(5)实验结束时,量筒Ⅰ中有x mL水,量筒Ⅱ中收集到y mL气体,则过氧化钠的纯度是(用含x、y的式子表示,上述体积均已折算成标准状况).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com