
����Ŀ�������±��е���Ϣ�����ش����⣺
Ԫ�� | Ԫ�ػ���Ԫ����ɵ��������� |
A | ��������Ȼ����Ӳ�����ȼ�ղ�����������ʹ����ʯ��ˮ����ǡ� |
B | ԭ�������������Ǵ������������� |
C | ������ɫ��ӦΪ��ɫ��������ȼ�����ɵ���ɫ���� |
D | �����ڿ��������������� |
E | ����Ϊ����ɫ��ȼ�ղ���������Ư���ԡ� |
F | ��ͬ�����������ܶ���С |
��1���õ���ʽд���γ�F2E�Ĺ���__________________��
��2��д��CBF���ʵĵ���ʽ______________��
��3��C2B2�����д��ڻ�ѧ����������___________ ��1 molC2B2������AB2��Ӧת�Ƶĵ�����Ϊ_______��
��4����B��C��E�γɵļ����Ӱ뾶�ɴ�С�Ĺ�ϵ��______________�������ӷ��ű�ʾ����
���𰸡� ![]()
![]() ���Ӽ����ۼ� NA S2����O2����Na+
���Ӽ����ۼ� NA S2����O2����Na+
��������������A��������Ȼ����Ӳ�����ȼ�ղ�����������ʹ����ʯ��ˮ�������A��C��Bԭ�������������Ǵ������������������������������ܳ���8�������B��O��C������ɫ��ӦΪ��ɫ��������ȼ�����ɵ���ɫ������C��Na��D�����ڿ��������������õ����ǵ�����D��N��E����Ϊ����ɫ��ȼ�ղ���������Ư������E��S��F����ͬ�����������ܶ���С��F��H��������ʵ���ɡ����ʷ������
��⣺�������Ϸ�����֪A��B��C��D��E��F�ֱ���C��O��Na��N��S��H����
��1��F2E�ǹ��ۻ��������⣬���õ���ʽ��ʾ���γɵĹ���Ϊ![]() ��
��
��2��CBF������NaOH���������Ӽ����ۼ������ӻ��������ʽΪ![]() ��
��
��3��C2B2�ǹ������ƣ��������д��ڻ�ѧ�������������Ӽ��ͷǼ��Լ���1 mol��������������CO2��Ӧ����̼���ƺ��������������Ƽ�����������Ҳ�ǻ�ԭ�������ת�Ƶĵ�����ΪNA��
��4�����ӵĺ�����Ӳ���Խ�࣬���Ӱ뾶Խ��������Ų���ͬʱ���Ӱ뾶��ԭ���������������С������B��C��E�γɵļ����Ӱ뾶�ɴ�С�Ĺ�ϵ��S2����O2����Na+��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���10 mL 0.40 mol��L-1 H2O2��Һ�м�������FeCl3��Һ����ͬʱ�̲������O2�������������Ϊ��״�������±���ʾ��
t / min | 0 | 2 | 4 | 6 |
V(O2) / mL | 0 | 9.9 | 17.2 | 22.4 |
������ʾ����Ӧ���������У�
��2Fe3++ H2O2 ![]() 2Fe2++O2��+2H+
2Fe2++O2��+2H+
�� H2O2 + 2Fe2++2H+ ![]() 2H2O+2Fe3+
2H2O+2Fe3+
��Ӧ�����������仯����ͼ��ʾ������˵������ȷ����

A. 0��6 min��ƽ����Ӧ���ʣ�v(H2O2) = 3.33��10-2 mol��L-1��min-1
B. Fe3+�������Ǽӿ��������ķֽ�����
C. ��Ӧ�������ȷ�Ӧ����Ӧ���Ƿ��ȷ�Ӧ
D. ��Ӧ2H2O2(aq)![]() 2H2O(l) + O2(g)�ġ�H =E1-E2 < 0
2H2O(l) + O2(g)�ġ�H =E1-E2 < 0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����к͵ζ����ⶨ�ռ�Ĵ��ȣ��ռ��е����ʲ����ᷴӦ���������ʵ��ش�
��1���������õ�8.8g�ռ���Ʒ���Ƴ�500mL����Һ�����ƹ���ʹ�õ���Ҫ������500mL����ƿ����Ͳ���ձ�����ͷ�ι��⣬����һ�ֱ���ʹ�õ������� ��
��2����ʽ�ζ�����ȡ10.00mL����Һ����ƿ�У����뼸�η�̪��
��3����0.20molL��1�ı�����ζ�����Һ���жϵζ��յ�������ǣ� ��
��4�����ʵ�������ȷ���ӵζ���ʼ����������Һ�е�����Ũ�ȹ�ϵ���Գ��ֵ����������ĸ��ţ�
A.c��Na+����c��Cl������c��H+����c��OH����
B.c��Na+����c��OH������c��Cl������c��H+��
C.c��Na+��+c��H+��=c��OH����+c��Cl����
D.c��Cl����+c��Na+����c��OH����+c��H+��
��5�������������ݼ��㣬c��NaOH�� mol/L
�ζ����� | ����Һ�����mL�� | �����������mL�� | |
�ζ�ǰ������mL�� | �ζ��������mL�� | ||
��һ�� | 10.00 | 0.60 | 20.50 |
�ڶ��� | 10.00 | 3.00 | 23.10 |
��6�������������֣�����ʵ��IJⶨ������ռ��ʵ�ʴ���ƫ�ߣ�������Ŀ���ԭ����
A.�ζ�ǰƽ�ӣ��ζ�����
B.δ�ñ�Һ��ϴ�ζ���
C.�ô���Һ��ϴ��ƿ
D.��С�Ľ���Һ������ƿ���森
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ��ֻ���ܺ���K+��NH4+��Fe2+��A13+��Cl-��SO42-��CO32-��A1O2-�е����������ӣ�����Ũ�Ⱦ�Ϊ0.1mol/L��ijͬѧ����������ʵ��: ����˵����ȷ����
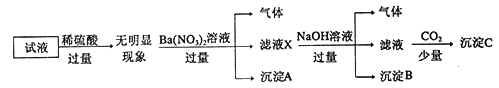
A. ԭ��Һ�д���NH4+��Fe2+��Cl-��SO42-
B. ��ҺX�д������ڵ���������NH4+��Fe2+��Ba2+
C. ��ȷ������C�ijɷ�
D. ��ȷ��ԭ��Һ���Ƿ���Al3+��Cl-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʯ�ͼ�ʽ̼����þ[MgaAlb��OH��c��CO3��dxH2O]�����������ж����ż�Ϊ��Ҫ��Ӧ�ã�ij�о�С���������ʯ��ȡ�������������ʣ��Լ���ʽ̼����þ�����չ���������о���������벢��ɶ��й�����Ľ��
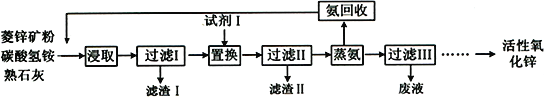
��1������ʯ����ȡ���ʺ�������������Ҫԭ�ϣ�����ʯ����ɺ��������ƣ�����������������������������ʣ�����ʵ�鲽����ͼ1��ʾ�� 
�ٲ���I������Ϊ
�ڻ�Ϸ��ϵ���Ҫ�ɷ�����д��ѧʽ����������Һ�����Ƿ���NH4+�ķ����ǣ�ȡ�ٻ���Һ�����Թ��У������м���������NaOH��Һ�����ȣ������������ܹ�ʹ �� ��֤����Һ���к���NH4+
��һ�������£����������������������Ӧ����������ĸ��
a��KSCN ��Һ b��Al c��NaOH ��Һ
�ܿ����ܹ�Ϊ������Ӧ�ṩ��������д��ѧʽ����
��2����ʽ̼����þ�dz���θҩ����ϲ������Ҫ�ɷ֣�Ϊȷ����ʽ̼����þ����ɣ�����������ʵ�飺
��ȡ��ʽ̼����þ��ĩ6.02g����������2.0molL��1����ʹ���ֻ�Ϸ�Ӧ����Ӧ�����в�����������V�����壩��������������V��HC1���Ĺ�ϵ��ͼ2��ʾ�����ʽ̼����þ����������̼��������ʵ���֮��Ϊ
�ڽ��ٷ�Ӧ��õ��Ļ��Һ�ٺ���������������Һ��ֻ�ϣ���Ӧ��ȫ�����ˡ�ϴ�ӡ�����ó���3.48g�����ʽ̼����þ�Ļ�ѧʽΪ �� 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������������ֱ���������HCl��NaOH��Һ��ַ�Ӧ��������ͬ��������������
A. 1�s2 B. 1�s3 C. 1�s1 D. 3�s1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ժ��ܷϴ���(��Ҫ�ɷ�ΪCo��Fe��SiO2)Ϊԭ�ϣ���ȡ�����ܵ��������¡�
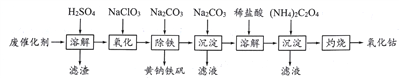
(1)�ܽ�:�ܽ����ˣ�������ϴ��2~3�Σ�ϴҺ����Һ�ϲ�����Ŀ����__________________��
(2)����:���Ƚ��������¼���NaC1O3����������_______________________________��
(3)����:����������Na2CO3������ȣ����ɻ�������Na2[Fe6(SO4)4(OH)12]������д���÷�Ӧ�Ļ�ѧ����ʽ:__________________________________________________��
(4)����:���ɳ�����ʽ̼����[(CoCO3)2��3Co(OH)2]��������ϴ�ӣ���������Ƿ�ϴ�Ӹɾ��IJ�����_________________________________________________________��
(5)�ܽ�:CoCl2���ܽ��������ͼ��ʾ�����ʽ̼�����м�������ϡ���ᣬ���ȱ߽�������ȫ�ܽ������ȹ��ˣ���ԭ����__________________________________��
(6)����:ȷ��ȡ����CoC2O4����2.205g���ڿ��������յõ��ܵ�һ��������1.205g��д����������Ļ�ѧʽ_________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������������ؾ���(K3[Fe(C2O4)3]��3H2O)������ˮ���������Ҵ����������Թ����У������¼������ֽ⡣���������������Ʊ�����������������и��⣺
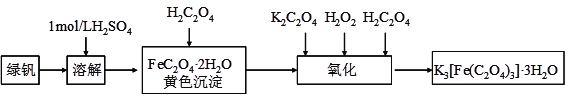
��1���ܽ�ʱ��ϡ�����������__________________________
��2�����ܽ�Һ����һ�����IJ��������У��γɻ�ɫ���������ˣ�ϴ�ӡ�
������ͼ�ǹ���װ��ͼ��ָ��ͼ���������Դ���һ����_____________________����һ����©�����¼��û�н������ܵ��ձ���
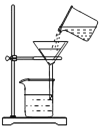
�����ȷ�������Ѿ�ϴ�Ӹɾ�____________________________________��
��3�����������г����Ͻ����⣬ά���¶���40�����ң�ԭ����___________________________��
��4��д�������������������������ص����ӷ���ʽ__________________________________��
��5�����������������ؾ�������¼��ɷֽ��������ֲ����Ρ�CO2�ȡ�д���÷ֽⷴӦ�Ļ�ѧ����ʽ______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������п���Ʊ���������п���ɱ��ͣ�ѡ���Ժã��乤���������£�
��1����������Ҫ�ɷֵĻ�ѧʽΪ__________��
��2����ȡҺ�к�����Pb2+��Cu2+���ؽ������ӣ��ɼ����Լ����ȥ���Լ���Ϊ______________������ʵ�ʲ���������ʵ�ʼ�����Զ���������������ܵ�ԭ����____________________________��
��3�����ˢ���õ�Zn(NH3)4CO3��Һ����ֱ���������ȿ�������ʽ̼��п[ZnCO3��2Zn(OH)2��H2O]�������䷴Ӧ��ѧ����ʽΪ____________________________��
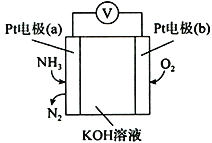
��4�����������л��в��ְ����ݳ������õ绯ѧ����������������NH3�ĺ�����ԭ����ͼ��ʾ�������ĵ缫��ӦΪ________________________________�����������������ݳ�����16.8L ����״�������봫��������һ����Ҫͨ���״����O2�����Ϊ____________________��
��5���������ʱ����Һ�в��ఱ������С��0.2mol/L��������ఱŨ�ȹ��ͣ��������������հ�ˮ�а�Ũ�Ƚ��ͣ�������ѭ��ʹ�ã�������ఱŨ�ȹ��ߣ��ᵼ��____________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com