
【题目】Al2O3是刚玉的主要成分.Al2O3属于( )
A.酸
B.盐
C.氧化物
D.单质
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知室温下乙醛的沸点为20.8℃,且与水互溶.用HgSO4做催化剂,在75℃左右,乙炔可水化为乙醛,但HgSO4遇到某些特定物质常会发生催化剂中毒而失去催化作用,H2S就是其中一种:现用乙炔水化法,只用块状电石、浓硫酸、水、NaOH溶液、HgO粉末五种物质制取乙醛,装置如图所示,请回答下列问题; 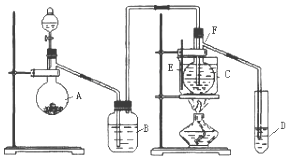
(1)实验开始时,仪器A中盛放电石,B中装NaOH溶液,其作用是 .
(2)仪器D中盛放水,其作用是吸收蒸气.
(3)蒸馏烧瓶F中应加入HgO和浓硫酸、水两种试剂,若将三者分别直接加入,请按加入的先后顺序写出包括HgO在内的各试剂的名称:氧化汞→→ .
(4)装置图中,加热F的方法叫 , 所选用温度计F的量程表示正确的是(填代号). A.0℃~50℃B.0℃~100℃C.0℃~200℃D. 0℃~360℃
(5)检验乙醛已制出的操作及现象是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定已部分变质的过氧化钠样品的纯度,设计如图所示的实验装置,图中Q为弹性良好的气球(不与药品反应),称取一定量的样品放入其中.按如图所示的装置安装好仪器,打开分液漏斗的活塞,将稀硫酸滴入气球中. 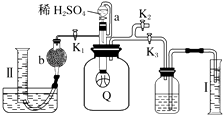
请回答下列问题:
(1)Q内发生反应生成种气体,其中的反应有个为氧化还原反应.
(2)为测定反应时生成气体的总体积,滴稀H2SO4前必须关闭(填“K1”、“K2”或“K3”),打开(填“K1”、“K2”或“K3”).
(3)当上述反应停止时,将K1、K2、K3均关闭,然后先打开K2 , 再缓缓打开K1 , 这时可观察到的现象是 .
(4)b中装的固体试剂是 , 需缓缓打开K1的原因为 .
(5)实验结束时,量筒Ⅰ中有x mL水,量筒Ⅱ中收集到y mL气体,则过氧化钠的纯度是(用含x、y的式子表示,上述体积均已折算成标准状况).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.1molN2中含有的分子数为2×6.02×1023
B.用激光笔照射CuSO4溶液可产生“丁达尔效应”
C.常温下,铝片能溶于浓硫酸
D.常温下,淀粉溶液遇I2变为蓝色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型锂离子电池电解质锂盐二氟草酸硼酸锂[LiBF2(C2O4)]的合成方法如下:2H2C2O4+SiCl4+2LiBF4→2LiBF2(C2O4)+SiF4+4HCl
(1)与氯同族的第四周期元素原子的基态核外电子排布式为_______________________。
(2)草酸分子(乙二酸,H2C2O4)中碳原子轨道的杂化类型是_____________,1mol草酸分子中含有σ键的数目为____________。
(3)与SiF4互为等电子体的阴离子的化学式为__________。BF4-的空间构型为_____________。
(4)第一电离能介于B、F两种元素之间的第二周期元素有__________种。
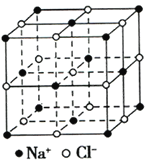
(5)已知NixO晶体晶胞结构为氯化钠型,由于晶体缺陷,x值小于1,一个Ni2+空缺,另有两个Ni2+被两个Ni3+取代,使化合物中Ni和O的比值发生了变化。某氧化镍样品组成为Ni0.93O,此晶体化学式为_______________________。(用含Ni2+、Ni3+表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨为重要化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a.CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H=+216.4kJ/mol
CO(g)+3H2(g) △H=+216.4kJ/mol
b.CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-41.2kJ/mol
CO2(g)+H2(g) △H=-41.2kJ/mol
则反应CH4(g)+2H2O(g)![]() CO2(g)+4H2(g) △H=_________。
CO2(g)+4H2(g) △H=_________。
(2)起始时投入氮气和氢气分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度关系如下图。
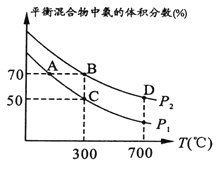
①恒压时,反应一定达到平衡状态的标志是______(填序号);
A.N2和H2的转化率相等 B.反应体系密度保持不变
C. ![]() 比值保持不变 D.
比值保持不变 D. ![]() =2
=2
②P1_____P2(填“>”、“<”、“=”、“不确定”,下同);反应平衡常数:B点____D点;
③C点H2的转化率____;在A、B两点条件下,该反应从开始到平衡时生成氨气平均速率:v(A)______v(B)。
(3)N2H4可作火箭推进剂,NH3和NaClO在一定条件下反应可生成N2H4。
①写出NH3和NaClO反应生成N2H4的化学方程式__________;
②已知25℃时N2H4水溶液呈弱碱性:N2H4+H2O![]() N2H5++OH- K1=1×10-a;N2H5++H2O
N2H5++OH- K1=1×10-a;N2H5++H2O![]() N2H62++OH- K2=1×10-b。
N2H62++OH- K2=1×10-b。
25℃时,向N2H4水溶液中加入H2SO4,欲使c(N2H5+)>c(N2H4),同时c(N2H5+)>c(N2H62+),应控制溶液pH范围_________(用含a、b式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是来自石油的重要有机化工原料,其产量用来衡量一个国家石油化工发展水平,E是具有果香味的有机物,F是一种高聚物,可制成多种包装材料。
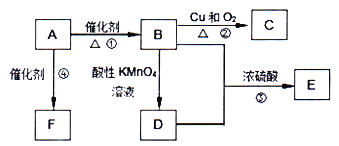
(1)A、D分子中的官能团分别名称为_______、_______。
(2)反应①的反应类型为________。
(3)反应②的化学方程式为_________。
(4)反应③的化学方程式为_______;该反应的反应类型为_____。
(5)反应④的化学方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是原子序数由小到大排列的五种短周期元素,其中A、B、C、D的原子序数之和为32,A是元素周期表中原了半径最小的元素,B、C左右相邻,C、D同主族。(请用具体的元素符号及化学用语作答)
(1)D在周期表中的位置为________________________。
(2)E元素的原子结构示意图为______________________。
(3)A与C组成原了个数比为1:1的化合物中含有的化学键为______(填“极性键”、“非极性键”或“离了键)。
(4)含有A、B、C、D四种元素的离子化合物X和Y:
①已知1molX能与足量NaOH浓溶液反应生成标准状况下44.8L气体,写出加热条件下X与NaOH浓溶液反应的离子方程式为_________________________________。
②已知1molY能与足量NaOH浓溶液反应生成标准状况下22.4L气体,Y又能与氯水反应,Y的化学式为_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com