
【题目】A、B、C、D、E是原子序数由小到大排列的五种短周期元素,其中A、B、C、D的原子序数之和为32,A是元素周期表中原了半径最小的元素,B、C左右相邻,C、D同主族。(请用具体的元素符号及化学用语作答)
(1)D在周期表中的位置为________________________。
(2)E元素的原子结构示意图为______________________。
(3)A与C组成原了个数比为1:1的化合物中含有的化学键为______(填“极性键”、“非极性键”或“离了键)。
(4)含有A、B、C、D四种元素的离子化合物X和Y:
①已知1molX能与足量NaOH浓溶液反应生成标准状况下44.8L气体,写出加热条件下X与NaOH浓溶液反应的离子方程式为_________________________________。
②已知1molY能与足量NaOH浓溶液反应生成标准状况下22.4L气体,Y又能与氯水反应,Y的化学式为_____________________________。
【答案】 第三周期VIA 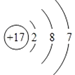 极性键、非极性键 NH4+ +OH-
极性键、非极性键 NH4+ +OH- ![]() NH3↑+H2O NH4HSO3
NH3↑+H2O NH4HSO3
【解析】分析:A、B、C、D、E是原子序数由小到大排列的五种短周期元素,其中A、B、C、D的原子序数之和为32,A是元素周期表中原子半径最小的元素,则A为H元素;B、C左右相邻,C、D位于同主族,设B的原子序数为x,则C原子序数为x+1,D原子序数为x+1+8,故1+x+x+1+x+1+8=32,解得x=7,故B为N元素,C为O元素,D为S元素,则E为Cl,据此解答。
详解:根据以上分析可知A、B、C、D、E分别是H、N、O、S、Cl。则
(1)硫元素的原子序数是16,在周期表中的位置为第三周期第VIA族;
(2)氯元素的原子序数是17,元素的原子结构示意图为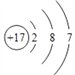 ;
;
(3)A与C组成原了个数比为1:1的化合物是H2O2,含有极性键、非极性键;
(4)由H、N、O、S四种元素组成的一种离子化合物X和Y。
①1molX能与足量NaOH浓溶液反应生成标准状况下44.8L气体,说明该物质阳离子为铵根,且1molX中含有2mol铵根,则X为硫酸铵或亚硫酸铵,铵根离子与氢氧根离子反应生成氨气,反应的离子方程式为NH4++OH-![]() NH3↑+H2O;
NH3↑+H2O;
②1molY能与足量NaOH浓溶液反应生成标准状况下22.4L气体,说明含有1个铵根。Y既能与盐酸反应,又能与氯水反应,故Y为亚硫酸氢铵,化学式为NH4HSO3。


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:
【题目】某化学反应中,设反应物的总能量为E1,生成物的总能量为E2。
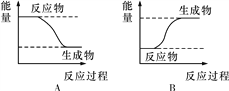
(1)若E1>E2,则该反应为________(填“放热”或“吸热”)反应。该反应可用图________(填“A”或“B”)表示。
(2)若E1<E2,则该反应为________(填“放热”或“吸热”)反应。该反应可用图________(填“A”或“B”)表示。
(3)太阳能的开发和利用是21世纪的一个重要课题。
①利用储能介质储存太阳能的原理是白天在太阳照射下,某种盐熔化,吸收热量;晚间熔盐释放出相应能量,从而使室温得以调节。已知下列数据:
盐 | 熔点/℃ | 熔化吸热/kJ·mol-1 | 参考价格/元·kg-1 |
CaCl2·6H2O | 29.0 | 37.3 | 780~850 |
Na2SO4·10H2O | 32.4 | 77.0 | 800~900 |
Na2HPO4·12H2O | 36.1 | 100.1 | 1 600~2 000 |
Na2S2O3·5H2O | 48.5 | 49.7 | 1 400~1 800 |
其中最适宜作储能介质的是________(填字母代号)。
A.CaCl2·6H2O B.Na2SO4·10H2O
C.Na2HPO4·12H2O D.Na2S2O3·5H2O
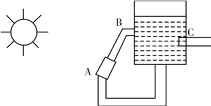
②下图是一种太阳能热水器的示意图,图中A是集热器,B是储水容器,C是供阴天时加热的辅助电热器。根据对水的密度的认识,你估计在阳光照射下水将沿________(填“顺”或“逆”)时针方向流动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有属于前四周期的A、B、C、D、E、F、G七种元素,原子序数依次增大.A元素的价电子构型为nsnnpn+1;C元素为最活泼的非金属元素,D元素核外有三个电子层,最外层电子数是核外电子总数的1/6;E元素正三价离子的3d轨道为半充满状态,F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒.
(1)A元素的第一电离能B元素的第一电离能(填“<”“>”或“=”),A、B、C三种元素电负性由小到大的顺序为(用元素符号表示).
(2)D元素原子的价电子排布式是 .
(3)C元素的电子排布图为;E3+的离子符号为 .
(4)F元素位于元素周期表的区,其基态原子的电子排布式为 .
(5)G元素可能的性质 .
A.其单质可作为半导体材料
B.其电负性大于磷
C.最高价氧化物对应的水化物是强酸.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用已知浓度盐酸滴定未知浓度的NaOH溶液,以酚酞作指示剂,下列操作会使所测NaOH溶液浓度偏低的是( )
A.锥形瓶洗净后还留有蒸馏水
B.取碱液的滴定管开始有气泡,放出液体后气泡消失
C.溶液颜色较浅时滴入酸液过快,停止滴定后反加一滴NaOH溶液无变化
D.用碱式滴定管取一定体积的NaOH溶液时,量取前仰视读数,量取后俯视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.甲烷与氯气发生置换反应生成一氯甲烷、二氯甲烷等
B.乙烯不能使酸性KMnO4溶液褪色
C.溴水与乙炔发生化合反应而褪色
D.苯不能与溴水发生加成反应说明苯分子中的碳碳键不是单双键交替
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关几种常见的金属和非金属及其化合物的说法正确的是( )
A.铝热反应是指铝能将所有的金属从其氧化物中置换出来
B.Na,Mg,Al,Fe,Cu都能导电,它们的氧化物都能与酸反应
C.CO2 , NO,SO2都是非金属氧化物,都属于酸性氧化物
D.CaCO3+SiO2 ![]() ?CaSiO3+CO2↑的发生,说明硅酸的酸性强于碳酸
?CaSiO3+CO2↑的发生,说明硅酸的酸性强于碳酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一些重要工业生产的转化关系(反应条件略去):请完成下列问题: 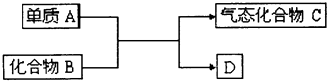
(1)若D是单质,且与A属于同一主族,反应在高温下进行,则:
①此反应的化学方程式是 .
②D单质的一种重要用途是 .
(2)若B为黄色固体,D为固体化合物,则该反应为4FeS2+11O2 ![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
①当有1molC生成时,该反应转移电子的总数是 .
②将C通入足量的酸性KMnO4 溶液中,发生反应的离子方程式为 .
(3)若B是一种碱性气体,D为化合物,则:
①该反应的化学方程式是 .
②B在加热条件下与CuO反应有Cu生成,该反应的化学方程式为;有人提出产物Cu中可能还含有Cu2O.已知Cu+在酸性溶液中不能稳定存在,为验证Cu2O是否存在,可取少量反应产物,滴加足量稀硫酸,若溶液由无色变为蓝色,则证明含有Cu2O.请写出发生反应的化学方程式: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com