

 �߲������Ӧ��һ��ͨϵ�д�
�߲������Ӧ��һ��ͨϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| m |
| 233 |
| V |
| 200 |
| m |
| 233 |
| V |
| 200 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
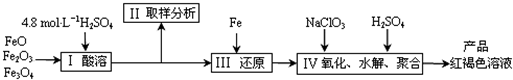
��10�֣��������Ļ�������������������������Ҫ����;��
(1)�ۺ�������(���PFS)�Ļ�ѧʽΪ [ Fe (OH)n(S04)(3-n) / 2 ]m ���ִ�DZˮ���������г�����PFS��ˮ�����γ���״��������ؽ������ӡ���PFS������ԭ��δ�ɶԵ�����Ϊ__ ����
(2)������������K4[Fe(CN)6]��������Ӱ�����û������д��ڵĻ�ѧ��������_____ ____��
��3��CNһ��̼ԭ�ӵ��ӻ���������� _______ ��д��һ����CNһ��Ϊ�ȵ�����ķ��ӵĻ�ѧʽ_____ ___��
(4)���Ȼ���������Ϊ���壬�۵�304�棬�е�3160C ��3000C���Ͽ�������������ˮ��Ҳ���������ѡ���ͪ���л��ܼ����ݴ��ж����Ȼ�������Ϊ______ ���塣
(5)��³ʿ����һ������������Ⱦ�ϣ����Ľṹ��Ԫ����ͼ��ʾ����³ʿ���� n(K+)��n(Fe3+)��n(Fe2+)��n(CNһ)= _____ ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010-2011ѧ�긣��ʡʦ���и߶���ѧ�����п��Ի�ѧ�Ծ� ���ͣ������
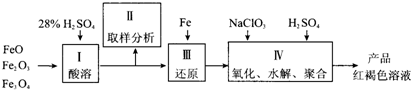
��10�֣��������Ļ������������������������� Ҫ����;��
Ҫ����;��
(1)�ۺ�������(���PFS)�Ļ�ѧʽΪ [ Fe (OH)n(S04) (3-n) / 2 ]m ���ִ�DZˮ���������г�����PFS��ˮ�����γ���״�� ���������ؽ������ӡ���PFS������ԭ��δ�ɶԵ�����Ϊ__ ����
���������ؽ������ӡ���PFS������ԭ��δ�ɶԵ�����Ϊ__ ����
(2)������������K4[Fe(CN)6]��������Ӱ�����û������д��ڵĻ�ѧ��������_____  ____ ��
____ ��
��3��CNһ��̼ԭ�ӵ��ӻ���������� _______ ��д��һ����CNһ��Ϊ�ȵ�����ķ��ӵĻ�ѧʽ_____ ___��
(4)���Ȼ���������Ϊ���壬�۵�304�棬�е�3160C ��3000C���Ͽ�������������ˮ��Ҳ���������ѡ���ͪ���л��ܼ����ݴ��ж����Ȼ�������Ϊ______ ���塣
(5)��³ʿ����һ������������Ⱦ�ϣ����Ľṹ��Ԫ����ͼ��ʾ����³ʿ���� n(K+)��n(Fe3+)��n(Fe2+)��n(CNһ)= _____ ___��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com