
 ��֪�й��Ȼ�ѧ����ʽΪ����4NH3��g��+5O2��g��4NO��g��+6H2O��g����H=-905kJ/mol����3H2��g��+N2��g��2NH3��g����H=-92.4kJ/mol����2H2��g��+O2��g��=2H2O��g����H=-483.6kJ/mol����N2��g��+O2��g��=2NO��g����H=QkJ/mol����Ӧ�����йػ�ѧ���ļ��ܣ�kJ/mol�����£�H-O��463��H-N��391��O=O��497
��֪�й��Ȼ�ѧ����ʽΪ����4NH3��g��+5O2��g��4NO��g��+6H2O��g����H=-905kJ/mol����3H2��g��+N2��g��2NH3��g����H=-92.4kJ/mol����2H2��g��+O2��g��=2H2O��g����H=-483.6kJ/mol����N2��g��+O2��g��=2NO��g����H=QkJ/mol����Ӧ�����йػ�ѧ���ļ��ܣ�kJ/mol�����£�H-O��463��H-N��391��O=O��497���� ��1�����ݷ�Ӧ��=��Ӧ����ܼ���-��������ܼ��ܼ��㣻���ݸ�˹���ɼ���Q��
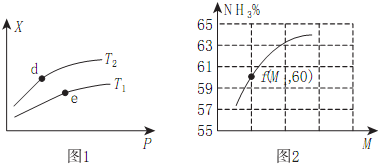
��2������X��ʾNH3�İٷֺ�����ѹǿһ���¶�Խ��ƽ��������У�����������С��
��ѹǿԽ��ƽ��������У�X���Ա�ʾ��������ƽ��Ħ�����������������ȣ�
��ͼ2��ʾ�¶�ΪT2ʱ��������Ϊ1L�����ܱ�����ʱ��������NH3��ƽ��ת�����뷴Ӧ��ʼʱ���ַ�Ӧ���Ͷ��֮�ȣ���M��ʾ���Ĺ�ϵ���˵��ת����Ϊ60%������ת�����淴Ӧ��ʼʱ���ַ�Ӧ���Ͷ��֮��M���������˵��M=b��a��
4NH3��g��+5O2��g��=4NO��g��+6H2O��g��
��ʼ����mol�� a b 0 0
�仯����mol�� 0.6a 0.75a 0.6a 0.9a
ƽ������mol�� a-0.6a b-0.75a 0.6a 0.9a
�ݴ˼�������ת���ʣ�
��3������������ԭ��Ӧ�������������Ϸŵ磬�������ӽ�����ɰ�����
��� �⣺��1����֪����4NH3��g��+5O2 ��g��?4NO��g��+6H2O��g����H=-905KJ/mol
��N2��g��+3H2��g��?2NH3��g����H=-92.4kJ/mol
��2H2��g��+O2��g���T2H2O��g������H=-483.6kJ/mol
���ݸ�˹���ɣ���+2����-3���ۣ���2�ɵâ�N2 ��g��+O2 ��g���T2NO ��g����H=+180.5KJ/mol��
��NO�еĻ�ѧ������Ϊx����Ӧ��4NH3��g��+5O2 ��g��?4NO��g��+6H2O��g����H=12��391+5��497-4x-12��463=-905�����x=631.5��
�ʴ�Ϊ��+180.5��631.5��
��2����4NH3��g��+5O2��g��4NO��g��+6H2O��g����H=-905kJ/mol����ӦΪ���ȷ�Ӧ����X��ʾNH3�İٷֺ�����ѹǿһ�����¶�Խ��ƽ��������У���������Խ�٣���T1��T2���¶�Խ��ƽ�ⳣ��ԽС��d��e���������Ӧ��ƽ�ⳣ��K��d����K��e����
�ʴ�Ϊ����������
��ѹǿԽ��ƽ��������У�
a����Ӧǰ�������������䣬ѹǿ����ƽ��������У��������ʵ�����С�����������ƽ��Ħ��������ѹǿ���������a��ȷ��
b��ѹǿ����ƽ��������У�NO�IJ��ʼ�С����b����
c����Hֵ����ѹǿ�仯����c����
�ʴ�Ϊ��a��
����ij�ܱ������г���amolNH3��bmolO2��������NH3��ƽ��ת�����뷴Ӧ��ʼʱ���ַ�Ӧ���Ͷ��֮�ȣ���M��ʾ���Ĺ�ϵ���˵��ת����Ϊ60%������ת�����淴Ӧ��ʼʱ���ַ�Ӧ���Ͷ��֮��M���������˵��M=b��a��
4NH3��g��+5O2��g��=4NO��g��+6H2O��g��
��ʼ����mol�� a b 0 0
�仯����mol�� 0.6a 0.75a 0.6a 0.9a
ƽ������mol�� a-0.6a b-0.75a 0.6a 0.9a
��M1=1.25�����ʱO2��ת����=$\frac{0.75a}{b}$��100%=$\frac{0.75}{1.25}$��100%=60%��
�ʴ�Ϊ��b��a��60��
��3������������ԭ��Ӧ�������������Ϸŵ磬�������ӽ�����ɰ������缫��ӦʽΪN2+6e-+6H+=2NH3��
�ʴ�Ϊ��N2+6e-+6H+=2NH3��
���� ���⿼���˸�˹���ɡ���Ӧ������ܵĹ�ϵ��Ӱ�컯ѧƽ��������Լ��йػ�ѧƽ��ļ��㡢ԭ���ԭ����ע�ض�ѧ�������Ŀ��飬��Ŀ�Ѷ��еȣ�ע��ͼ�����߱仯������ƽ�ⳣ��Ӱ�����ء���ѧƽ���ƶ�ԭ����Ӧ�õȣ�


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������


 ��
�� ��
�� �ж���ͬ���칹�壬���к���1��ȩ����2���ǻ��ķ����廯���ﹲ��
�ж���ͬ���칹�壬���к���1��ȩ����2���ǻ��ķ����廯���ﹲ�� ������ķ�����
������ķ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���뼸������ͭ��Һ | B�� | ����������ˮ | ||
| C�� | ��������NaCl��Һ | D�� | �ټ�������ϡ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
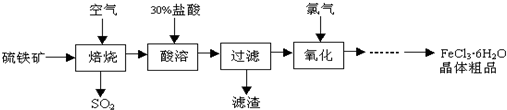
 +6SO2����
+6SO2���� �еĻ�ѧʽΪFe3O4����Ӧ�л��ϼ����ߵ�Ԫ����������
�еĻ�ѧʽΪFe3O4����Ӧ�л��ϼ����ߵ�Ԫ�����������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �״���Ϊ�������л�������Ʒ�ͻ�������ȼ�Ͼ��й�����Ӧ��ǰ����������̼����ϳɼ״��Ǻ������ö�����̼����Ч;�����ɶ�����̼�Ʊ��״������п����漰��Ӧ���£�
�״���Ϊ�������л�������Ʒ�ͻ�������ȼ�Ͼ��й�����Ӧ��ǰ����������̼����ϳɼ״��Ǻ������ö�����̼����Ч;�����ɶ�����̼�Ʊ��״������п����漰��Ӧ���£��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ԭ�ӵ�ԭ�ӽṹʾ��ͼ��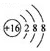 | |
| B�� | ԭ�Ӻ�����10�����ӵ���ԭ��${\;}_{8}^{18}$O | |
| C�� | NH4Cl�ĵ���ʽ��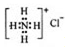 | |
| D�� | ���ȼױ��Ľṹ��ʽ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ͨ��CH4�ĵ缫Ϊ���� | B�� | ��������������Ӧ | ||
| C�� | ��Һ�е�OH-���ƶ� | D�� | ����һ��ʱ���Ӧ����KOH |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com