
【题目】有机物分子中原子间(或原子与原子团间)的相互影响会导致物质化学性质的不同。下列事实不能说明上述观点的是
A. 苯酚能跟NaOH溶液反应,乙醇不能与NaOH溶液反应
B. 甲苯能使酸性高锰酸钾溶液褪色,乙烷不能使酸性高锰酸钾溶液褪色
C. 乙烯能发生加成反应,乙烷不能发生加成反应
D. 苯与硝酸在加热时发生取代反应,甲苯与硝酸在常温下就能发生取代反应
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如图表示在一定的温度下,容积固定的密闭容器中,A、B、C三种气体物质的浓度随时间变化的情况,试回答下列问题:
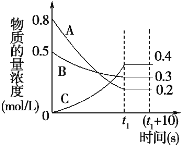
(1)该反应的化学方程式为 。
(2)0~t1s 内B气体的平均反应速率为 。
(3)(t1+10)s 时,A的转化率为 ,此时v(A)正 v(B)逆(填“>”、“<”或“=”)。
(4)关于该反应的说法正确的是 。
a.到达t1时刻该反应已停止
b.在t1时刻之前B气体的消耗速率大于它的生成速率
c.在t1时刻C气体的正反应速率等于逆反应速率
(5)容器中(t1+10)s时的压强与起始时的压强之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学──选修2:化学与技术】
利用硫酸渣(主要含Fe2O3、SiO2、Al2O3、MgO等杂质)制备氧化铁的工艺流程如下:

(1)“酸浸”中硫酸要适当过量,目的是:①提高铁的浸出率,② 。
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO42-,该反应的离子方程式为 。
(3)为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量。实验步骤为:
准确量取一定体积的酸浸后的溶液于锥形瓶中,加入HCl、稍过量SnCl2,再加HgCl2除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7标准溶液滴定,有关反应方程式如下:
2Fe3++Sn2++6Cl-=2Fe2++SnCl62-,
Sn2++4Cl-+2HgCl2=SnCl62-+Hg2Cl2↓,
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O。
①若SnCl2不足量,则测定的Fe3+量 (填“偏高”、“偏低”、“不变”,下同)。
②若不加HgCl2,则测定的Fe3+量 。
(4)①可选用 (填试剂)检验滤液中含有Fe3+。产生Fe3+的原因是 (用离子反应方程式表示)。
②已知部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:

实验可选用的试剂有:稀HNO3、Ba(NO3)2溶液、酸性KMnO4溶液、NaOH溶液,要求制备过程中不产生有毒气体。请完成由“过滤”后的溶液模拟制备氧化铁的实验步骤:
a. 氧化: ;
b. 沉淀: ;
c. 分离,洗涤;
d. 烘干,研磨。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),图1表示该反应过程中能量(单位为kJ·mol—1)的变化。
CH3OH(g)+H2O(g),图1表示该反应过程中能量(单位为kJ·mol—1)的变化。

(1)该反应为 热反应,原因是 。
(2)下列能说明该反应已经达到平衡状态的是 (填序号)
A.v(H2)=3v(CO2)
B.容器内气体压强保持不变
C.v逆(CO2)=v正(CH3OH)
D.容器内气体密度保持不变
(3)在体积为1 L的密闭容器中,充入1 molCO2和3 molH2,测得CO2和CH3OH(g)的浓度随时间变化如图2所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H2)= 。 达平衡时容器内平衡时与起始时的压强之比 。
(4)甲醇、氧气在酸性条件下可构成燃料电池,其负极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中的每个字母表示一种短周期元素,回答下列问题:
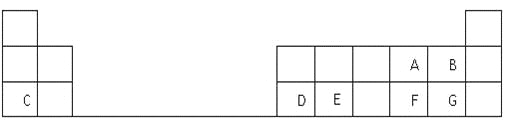
(1)G在元素周期表中的位置是 。
(2)A、B、C三种元素的简单离子半径由大到小的顺序为 (用离子符号表示)。
(3)写出C和F两种元素形成的化合物的电子式 ,
(4)元素E是构成地壳的主要元素之一,其氧化物是制光导纤维的基本原料,该氧化物中含有的化学键是 键(填“离子”或“共价”),属于 晶体(填晶体类型),写出该氧化物与C元素最高价氧化物水化物反应的离子方程式 。
(5)C离子的氧化性比D离子的氧化性 ,(填“强”或“弱”),其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能证明苯酚具有弱酸性的实验是()
A. 加入浓溴水生成白色沉淀
B. 苯酚钠溶液中通入CO2后,溶液由澄清变浑浊
C. 浑浊的苯酚加热后变澄清
D. 苯酚的水溶液中加NaOH溶液,生成苯酚钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1 mol·L-1 NaOH溶液450 mL和0.5 mol·L-1硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是①______________(填序号),配制上述溶液还需用到的玻璃仪器是②____________(填仪器名称)。
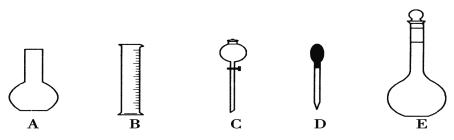
(2)根据计算用托盘天平称取NaOH的质量为③________g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度④__________0.1 mol·L-1(填“大于”、“等于”或“小于”)。
(3)由计算知,所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为⑤________mL(计算结果保留一位小数)。如果实验室有15 mL、20 mL、50 mL量筒,应选用⑥________mL量筒最好。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是将浓硫酸沿烧杯壁缓缓倒入水中,并用玻璃棒不断搅拌。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有如下三个热化学方程式:
2H2(g)+O2(g)=2H2O(g) 放热Q1 kJ
2H2(g)+O2(g)=2H2O(l) 放热Q2 kJ
H2(g)+1/2O2(g)=H2O(g) 放热Q3 kJ,其中Q1 Q2 Q3 大小关系是
A.Q1=Q2=Q3 B.2Q3=Q1<Q2
C.Q3<Q2<Q1 D.Q1<Q2<3Q3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NaCl等为原料制备KClO4的过程如下:
①在无隔膜、微酸性条件下,发生反应:NaCl+H2O—NaClO3+H2↑(未配平)
②在NaClO3溶液中加入KCl发生复分解反应,降温结晶,得KClO3。
③一定条件下反应:4KClO3=3KClO4+KCl,将产物分离得到KClO4。

(1)电解时,产生质量为2.13g NaClO3,同时得到H2的体积为________L(标准状况)。
(2)向NaClO3溶液中加入KCl能得到KClO3的原因是______________。
(3)该过程制得的KClO4样品中含少量KCl杂质,为测定产品纯度进行如下实验:
准确称取5.689g样品溶于水中,配成250mL溶液,从中取出25.00mL于锥形瓶中,加入适量葡萄糖,加热使ClO4-全部转化为Cl-(反应为:3 KClO4 +C6H12O6 ═ 6 H2O + 6 CO2↑ + 3 KCl),加入少量K2CrO4溶液作指示剂,用0.20mol/L AgNO3溶液进行滴定至终点,消耗AgNO3溶液体积21.00mL。滴定达到终点时,产生砖红色Ag2CrO4沉淀。
①已知: Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.1×10-12,若c(CrO42-)=1.1×10-4mol/L,则此时c(Cl-)=__________mol/L。
②计算KClO4样品的纯度(请写出计算过程。)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com