
【题目】Na2O2、CaC2都是离子化合物,都能与水反应放出气体。(Na2O2+2H2O=4NaOH+O2)它们( )
A.阴阳离子个数比均为![]() B.都含有非极性的共价键
B.都含有非极性的共价键
C.与水都发生氧化还原反应D.放出的都是可燃性气体
 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
【题目】早在1998年,中国科学家便成功地在较低温度下制造出金刚石:CCl4+4Na![]() C(金刚石)+4NaCl。这项成果被“美国化学与工程新闻”评价为“稻草变黄金”。回答下列问题:
C(金刚石)+4NaCl。这项成果被“美国化学与工程新闻”评价为“稻草变黄金”。回答下列问题:
(1)Ni原子价层电子的排布式为_______。元素C、Cl、Na中,第一电离能最大的是______________。
(2)石墨在高温高压下也可转变为金刚石。在石墨和金刚石中,C原子的杂化类型分别为_____________,熔点较高的是_____________,其原因为_______________。
(3)NH3易与Ni形成配合物 [Ni(NH3)6]SO4,该配合物中存在的化学键类型有_____________,其阴离子的空间构型为_____________。
(4)金属间化合物MgCNi3是一种新型超导体,呈钙钛矿构型,X射线衍射实验测得其晶胞参数为a=0.3812nm,其晶胞结构如图所示。晶胞中C位于Ni所形成的正八面体的体心,该正八面体的边长为___________nm。(![]() =1.414)
=1.414)
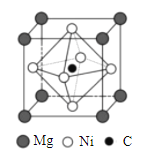
(5)在MgCNi3晶胞结构的另一种表示中,Mg处于体心位置,则C处于________________位置,Ni处于_______________位置。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸铵(![]() )是复合火箭推进剂的重要成分。通过如图所示的装置及实验步骤可以测定某高氯酸铵样品的纯度。
)是复合火箭推进剂的重要成分。通过如图所示的装置及实验步骤可以测定某高氯酸铵样品的纯度。
步骤1:检查装置气密性。
步骤2:准确称取样品![]() 于蒸馏烧瓶中,加入约
于蒸馏烧瓶中,加入约![]() 水溶解。
水溶解。
步骤3:准确量取![]() 溶液于锥形瓶中。
溶液于锥形瓶中。
步骤4:经仪器A向蒸馏瓶中加入![]() 溶液。
溶液。
步骤5:加热蒸馏至蒸馏烧瓶中剩余约100mL溶液。
步骤6:用新煮沸过的水冲洗冷凝装置2~3次,洗涤液并入锥形瓶中。
步骤7:向锥形瓶中加入酸碱指示剂,用![]() 标准溶液滴定至终点,消耗NaOH标准溶液
标准溶液滴定至终点,消耗NaOH标准溶液![]() 。
。
步骤8:将实验步骤1~7重复2次。

(1)仪器A的名称是______________。
(2)计算样品中高氯酸铵的质量分数_________(写出计算过程,已知杂质不参与反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人类较早使用的金属之一。运用铁及其化合物的有关知识,回答下列问题:
(1)铁和铁合金是生活中的常用材料,下列叙述中,正确的是________。
A.纯铁硬度比生铁高
B.纯铁耐腐蚀性强,不易生锈
C.不锈钢是铁合金,只含金属元素
D.铁在一定条件下可与水蒸气反应
E.铁在冷的浓硫酸中钝化
(2)向沸水中逐滴加1mol/LFeCl3溶液,至液体呈透明的红褐色,该反应的离子方程式为____________,形成该分散系的微粒直径范围是_________。
(3)电子工业需用30%FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板。请写出FeCl3溶液与铜反应的离子方程式_________。欲从腐蚀后的废液中回收铜并重新获得FeCl3溶液,现有下列试剂:①氯气、②铁粉、③浓硝酸、④浓盐酸、⑤烧碱、⑥浓氨水,需用用到的一组试剂是__________。
A. ①②④ B. ①③④⑥ C. ②④⑤ D. ①④⑥
(4)高铁酸钠Na2FeO3是一种新型净水剂。
①高铁酸钠主要通过如下反应制取:2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3X+5H2O,则X的化学式为__________。
②高铁酸钠在水中可以发生如下反应:FeO42-+10H2O=4Fe(OH)3+8OH-+3O2。由此看来,高铁酸钠能够杀菌消毒是因为它具有_____性,而能够除去水中悬浮物是因为________。
③下列物质能作净水削的有_________。
a.KAl(SO4)2·12H2O b.聚合硫酸铁[Fe(OH)(SO4)]n c.ClO2 d.“84消毒液”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Cu+2Fe3+=Cu2++2Fe2+”设计一个原电池(正极材料用碳棒),回答下列问题:
该电池的负极材料是___,发生___反应(填“氧化”或“还原”);电解质溶液是___;若导线上转移电子1mol,则被氧化的物质___克。
(2)已知拆开1molH—H键、1molN≡N分别需要吸收的能量为akJ、bkJ,形成1molN—H键需要释放ckJ能量。且已知N2和H2合成NH3的反应是放热反应,则生成1molNH3需要放出___的热量。
(3)铜与一定量浓硝酸恰好完全反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,将这些气体与1.68LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸,若向所得硝酸铜溶液中加入6mol·L-1NaOH溶液至Cu2+恰好完全沉淀,消耗NaOH溶液的体积是___mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A. 18g重水(D2O)所含的电子数目为10NA
B. Na2O2与足量的水反应生成1 molO2,转移电子数目为2NA
C. 100 mL1 molL-1 FeCl3溶液中含有 Fe3+数目为 0.1NA
D. 将2molSO2和1molO2充分反应,转移的电子数目为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用 0. 100 mol L-1 的盐酸滴定 0.1 00 molL-1 的氨水,其滴定曲线如图所示:
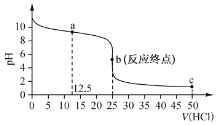
下列说法正确的是
A. 该滴定操作可用甲基橙作指示剂
B. a 点溶液中:c(NH4+)>c(NH3 H2O)>c(Cl- )
C. c 点溶液中:c(Cl-)>c(NH4+)>c(H+)
D. a→c过程中锥形瓶内水的电离度不断增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年诺贝尔化学奖在10月3日揭晓,弗朗西斯阿诺德、乔治史密斯和格雷戈里温特尔共同获奖,以表彰他们在酶的定向演化以及用于多肽和抗体的噬菌体展示技术方面取得的成果。如图所示是木瓜蛋白酶(蛋白质)的结构简式,下列说法不正确的是( )
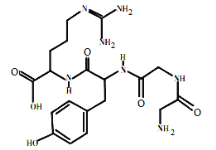
A. 醋酸铅可使木瓜蛋白酶变性
B. 木瓜蛋白酶含有苯环,属于芳香烃
C. 木瓜蛋白酶能发生水解反应、加成反应
D. 木瓜蛋白酶能与碳酸钠反应生成CO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是物质间发生化学反应的颜色变化,其中物质a、b、c、d对应的物质正确的是( )
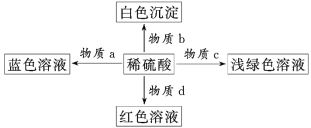
选项 | 物质a | 物质b | 物质c | 物质d |
A | Cu2(OH)2CO3 | Ba(OH)2 | Fe(OH)3 | 酚酞溶液 |
B | CuO | NaAlO2 | Fe2O3 | 紫色石蕊溶液 |
C | CuO | BaCl2 | FeO | 酚酞溶液 |
D | Cu(OH)2 | Ba(NO3)2 | FeO | 紫色石蕊溶液 |
A. AB. BC. CD. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com