
【题目】(1)理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Cu+2Fe3+=Cu2++2Fe2+”设计一个原电池(正极材料用碳棒),回答下列问题:
该电池的负极材料是___,发生___反应(填“氧化”或“还原”);电解质溶液是___;若导线上转移电子1mol,则被氧化的物质___克。
(2)已知拆开1molH—H键、1molN≡N分别需要吸收的能量为akJ、bkJ,形成1molN—H键需要释放ckJ能量。且已知N2和H2合成NH3的反应是放热反应,则生成1molNH3需要放出___的热量。
(3)铜与一定量浓硝酸恰好完全反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,将这些气体与1.68LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸,若向所得硝酸铜溶液中加入6mol·L-1NaOH溶液至Cu2+恰好完全沉淀,消耗NaOH溶液的体积是___mL。
【答案】Cu 氧化 FeCl3溶液 32 (3c-1.5a-0.5b)kJ 50
【解析】
(1)根据总反应式Cu+2Fe3+=Cu2++2Fe2+,Cu发生氧化反应,所以Cu作负极,负极反应为Cu-2e-=Cu2+,用碳棒作正极,FeCl3溶液作电解质溶液,Fe3+在正极得到电子,正极反应为Fe3++e-=Fe2+,据此分析解答;
(2)根据物质结构计算断键吸收和成键释放的能量,进而计算反应热;
(3)向所得硝酸铜溶液中加入NaOH溶液至Cu2+恰好完全沉淀,沉淀为Cu(OH)2,由电荷守恒可知,Cu提供电子物质的量等于氢氧化铜中氢氧根的物质的量,生成NO2、NO的混合气体与1.68L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸,纵观整个过程,由电子转移守恒,可知Cu提供电子等于氧气获得的电子,据此计算n(NaOH),进而计算消耗氢氧化钠溶液体积。
(1)根据上述分析可知,Cu作负极,发生氧化反应,电解质溶液为FeCl3溶液,若导线上转移1mol电子,根据负极反应Cu-2e-=Cu2+可知,负极0.5molCu被氧化,被氧化的Cu的质量=0.5mol×64g/mol=32g,故答案为:Cu;氧化;FeCl3;32;
(2)根据化学方程式N2+3H2![]() 2NH3,生成1mol的NH3时需要消耗0.5mol的N2和1.5mol的H2,因此在上述的反应过程中断裂0.5mollN≡N键和1.5molH—H键,共吸收热量为0.5bkJ+1.5akJ=(0.5b+1.5a)kJ,形成1molNH3中的3molN—H键,共放出热量3ckJ,已知该反应为放热反应,则反应共放出3c-(0.5b+1.5a)=(3c-1.5a-0.5b)kJ的热量,故答案为:(3c-1.5a-0.5b)kJ;
2NH3,生成1mol的NH3时需要消耗0.5mol的N2和1.5mol的H2,因此在上述的反应过程中断裂0.5mollN≡N键和1.5molH—H键,共吸收热量为0.5bkJ+1.5akJ=(0.5b+1.5a)kJ,形成1molNH3中的3molN—H键,共放出热量3ckJ,已知该反应为放热反应,则反应共放出3c-(0.5b+1.5a)=(3c-1.5a-0.5b)kJ的热量,故答案为:(3c-1.5a-0.5b)kJ;
(3)NO2、N2O4、NO混合气体与1.68LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸,说明整个过程中被还原的HNO3反应前后没有变化,即Cu失去的电子都被O2得到了,根据得失电子守恒建立关系式:n(Cu)×2=n(O2)×4,解得n(Cu)=0.075mol×2=0.15mol,根据Cu原子个数守恒可知Cu(NO3)2为0.15mol;根据 Cu2+—2OH-得NaOH为0.15mol×2=0.3mol,则NaOH溶液的体积V为0.3mol/6mol·L-1=50mL,故答案为:50。


科目:高中化学 来源: 题型:
【题目】下列生产或实验事实引出的结论不正确的是( )
选项 | 事实 | 结论 |
A | 其他条件相同,Na2S2O3溶液和H2SO4溶液反应,升高溶液的温度,析出硫沉淀所需时间缩短 | 当其他条件不变时,升高反应 温度,化学反应速率加快 |
B | 工业制硫酸过程中,在SO3的吸收阶段,吸收塔里要装填瓷环 | 增大气液接触面积,使SO3的吸收速率增大 |
C | 在容积可变的密闭容器中发生反应:2NH3(g) | 反应速率减慢 |
D | A.B两支试管中分别加入等体积5%的H2O2溶液,在B试管中加入2~3滴FeCl3溶液,B试管中产生气泡快 | 当其他条件不变时,催化剂可 以改变化学反应速率 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下发生反应2SO3(g)![]() 2SO2(g)+O2(g),将1molSO3气体通入1L容积恒定的密闭容器中,维持容器内温度不变,5min末测得SO3的物质的量为0.4mol。则下列说法正确的是( )
2SO2(g)+O2(g),将1molSO3气体通入1L容积恒定的密闭容器中,维持容器内温度不变,5min末测得SO3的物质的量为0.4mol。则下列说法正确的是( )
A. 0~5min,O2的生成速率v(O2)=0.06mol·L-1·min-1
B. 若起始时充入3molSO3,起始时SO3分解速率不变
C. 若某时刻消耗了0.5molSO3同时生成了0.25molO2,则表明该反应达到了平衡状态
D. 达到平衡时,SO2和SO3的浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是核电荷数依次增大的六种短周期主族元素,A元素的原子核内只有1个质子;B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族。(请用化学用语回答下列问题)
(1)B在周期表中的位置_______________
(2)F元素的最高价氧化物对应的水化物的化学式为_____。
(3)用电子式表示化合物D2C的形成过程____________。C、D还可形成化合物D2C2,其电子式为____________。
(4)C、E的氢化物,沸点由高到低顺序是:__________其原因是_____________。
(5)写出碳单质与B的最高价氧化物对应水化物浓溶液反应的化学方程式,并用单线桥标明电子的转移方向_________。当转移电子为0.2mol时,标准状况下反应产生气体_______L
(6)已知E单质和F单质的水溶液反应会生成两种强酸,其化学反应方程式为:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一选修3:物质结构与性质]太阳能电池板材料除单品硅外,还有含铜、铟、镓、硒等元素的化学物质。
(1)基态硅原子的价电子轨道表达式__________。
(2)有一类组成最简单的有机硅化合物叫硅烷。硅烷的组成、结构与相应的烷烃相似。硅烷中硅采取________杂化方式,硅烷的沸点与相对分子质量的关系如下图所示现这种变化的原因是_________。

(3)硒和硫同为VIA族元素,与其相邻的元素有砷和溴,则三种元素的电负性由小到大的顺序为____________(用元素符号表示)。
(4)气态SeO3分子的立体构型为_________,与SeO3互为等电子体的一种阴离子为_______(填化学式)。
(5)CuCl的盐酸溶液吸收CO形成氯化羰基亚铜[CuCl(CO)2 H2O,通常形成二聚体,结构示意图如下。则该化合物中与Cu+形成配位键的原子是_________。

(6)—种铜金合金晶体具有面心立方最密堆枳结构,在晶胞中金原子位于顶点,铜原子位于面心,则该合金中铜原子(Cu)与金原子(Au)个数比为____________,若该晶体的晶胞棱长为a nm,则该合金密度为____________(列出计算式,不要求计算结果,阿伏加徳罗常数的值为NA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O2、CaC2都是离子化合物,都能与水反应放出气体。(Na2O2+2H2O=4NaOH+O2)它们( )
A.阴阳离子个数比均为![]() B.都含有非极性的共价键
B.都含有非极性的共价键
C.与水都发生氧化还原反应D.放出的都是可燃性气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
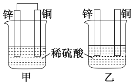
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的c(H+)均减小
D.产生气泡的速率甲比乙慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列“实际应用”对应“化学知识原理”说法错误的是( )
选项 | 实际应用 | 化学知识原理 |
A | 泡沫灭火器中装有碳酸氢钠溶液 和硫酸铝溶液 | 碳酸氢钠溶液和硫酸铝溶液水解且相互促进 |
B | 工业上采用高压(20-50MPa)合成NH3 | 应用勒夏特列原理 |
C | 施加石膏降低盐碱地(含Na2CO3)的碱性 | CaCO3溶度积小于CaSO4 |
D | 选用金属锂做电池电极材料 | 锂轻且在空气中稳定 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是Cu-Zn原电池的装置示意图,下列叙述正确的是( )
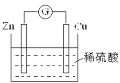
A.Zn片是正极
B.H+在铜片上得电子
C.反应过程中电能转变为化学能
D.电子从锌片通过硫酸溶液流向铜片
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com