
【题目】下列生产或实验事实引出的结论不正确的是( )
选项 | 事实 | 结论 |
A | 其他条件相同,Na2S2O3溶液和H2SO4溶液反应,升高溶液的温度,析出硫沉淀所需时间缩短 | 当其他条件不变时,升高反应 温度,化学反应速率加快 |
B | 工业制硫酸过程中,在SO3的吸收阶段,吸收塔里要装填瓷环 | 增大气液接触面积,使SO3的吸收速率增大 |
C | 在容积可变的密闭容器中发生反应:2NH3(g) | 反应速率减慢 |
D | A.B两支试管中分别加入等体积5%的H2O2溶液,在B试管中加入2~3滴FeCl3溶液,B试管中产生气泡快 | 当其他条件不变时,催化剂可 以改变化学反应速率 |
A.AB.BC.CD.D
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】实验室制备 1,2 —二溴乙烷的反应原理如下:①CH3CH2OH在浓硫酸170℃条件下生成CH2=CH2②CH2=CH2与Br2反应生成BrCH2CH2Br。现用少量溴和50gCH3CH2OH制备1,2 —二溴乙烷。回答下列问题:
(1)制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是_______。
A 加快反应速度 B 引发反应 C 防止乙醇挥发 D 减少副产物乙醚生成
(2)判断该制备反应已经结束的最简单方法是___________________。
(3)将 1,2 —二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在_____层。
(4)若产物中有少量副产物乙醚,可用____________的方法除去。
(5)若最终得到纯净1,2 —二溴乙烷94g,本实验的产率是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+3B(g)![]() 2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率分别如下,其中反应速率最大的是( )
2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率分别如下,其中反应速率最大的是( )
A. v(A)=0.15mol/(Lmin)
B. v(B)=0.04mol/(Ls)
C. v(C)=0.03mol/(Ls)
D. v(D)=0.4mol/(Lmin)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有化合物
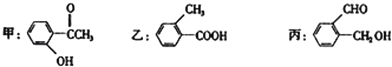
(1)请写出甲中含氧官能团的名称:________
(2)请判别上述哪些化合物互为同分异构体:_______
(3)甲、乙、丙三种物质中,遇FeCl3溶液显紫色的是_____(填“甲”“乙”或“丙”,下同),能与银氨溶液发生银镜反应的是_____,能与碳酸钠溶液反应放出CO2气体的是_____
(4)请按酸性由强至弱排列甲、乙、丙的顺序:_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硅及其化合物的说法正确的是( )
A.陶瓷、玻璃、水泥容器都能贮存氢氟酸
B.硅酸钠属于盐,不属于碱,所以硅酸钠可以保存在具有磨口玻璃塞的试剂瓶中
C.用SiO2制取硅酸,应先使二氧化硅与氢氧化钠溶液反应,然后再通入CO2
D.由Na2CO3+SiO2![]() CO2↑+Na2SiO3可知,硅酸的酸性强于碳酸
CO2↑+Na2SiO3可知,硅酸的酸性强于碳酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】早在1998年,中国科学家便成功地在较低温度下制造出金刚石:CCl4+4Na![]() C(金刚石)+4NaCl。这项成果被“美国化学与工程新闻”评价为“稻草变黄金”。回答下列问题:
C(金刚石)+4NaCl。这项成果被“美国化学与工程新闻”评价为“稻草变黄金”。回答下列问题:
(1)Ni原子价层电子的排布式为_______。元素C、Cl、Na中,第一电离能最大的是______________。
(2)石墨在高温高压下也可转变为金刚石。在石墨和金刚石中,C原子的杂化类型分别为_____________,熔点较高的是_____________,其原因为_______________。
(3)NH3易与Ni形成配合物 [Ni(NH3)6]SO4,该配合物中存在的化学键类型有_____________,其阴离子的空间构型为_____________。
(4)金属间化合物MgCNi3是一种新型超导体,呈钙钛矿构型,X射线衍射实验测得其晶胞参数为a=0.3812nm,其晶胞结构如图所示。晶胞中C位于Ni所形成的正八面体的体心,该正八面体的边长为___________nm。(![]() =1.414)
=1.414)
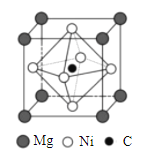
(5)在MgCNi3晶胞结构的另一种表示中,Mg处于体心位置,则C处于________________位置,Ni处于_______________位置。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将100mL稀硝酸和稀硫酸的混合酸溶液平均分成两份。向其中一份中逐渐加入铜粉最多能溶解9.6g(假设此时硝酸只被还原为NO,下同);向另一份中逐渐加入铁粉,产生气体的量随铁粉质量的变化如图所示。则下列判断中错误的是( )
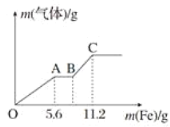
A.原混合酸溶液中H2SO4的浓度为2.0molL-1B.A点对应消耗NO3-物质的量为0.1mol
C.B点对应消耗铁粉的质量为8.4gD.OA段产生的气体是NO,BC段产生的气体是H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)![]() 的名称是_______。
的名称是_______。
(2)分子式符合C7H16且含有四个甲基的结构有__________种。
(3)核磁共振仪处理![]() ,氢谱图中有___种氢,峰面积之比为____。
,氢谱图中有___种氢,峰面积之比为____。
(4)水的熔沸点比同主族其它氢化物的都高,原因是______。
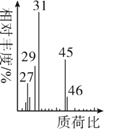
(5)将有机物A置于氧气流中充分燃烧,实验测得:生成5.4gH2O和8.8gCO2,消耗氧气6.72L(标准状况下),则A的实验式是___,用质谱仪测定A的相对分子质量,得到如图所示质谱图,则其相对分子质量为____,A的分子式是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Cu+2Fe3+=Cu2++2Fe2+”设计一个原电池(正极材料用碳棒),回答下列问题:
该电池的负极材料是___,发生___反应(填“氧化”或“还原”);电解质溶液是___;若导线上转移电子1mol,则被氧化的物质___克。
(2)已知拆开1molH—H键、1molN≡N分别需要吸收的能量为akJ、bkJ,形成1molN—H键需要释放ckJ能量。且已知N2和H2合成NH3的反应是放热反应,则生成1molNH3需要放出___的热量。
(3)铜与一定量浓硝酸恰好完全反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,将这些气体与1.68LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸,若向所得硝酸铜溶液中加入6mol·L-1NaOH溶液至Cu2+恰好完全沉淀,消耗NaOH溶液的体积是___mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com