
【题目】将100mL稀硝酸和稀硫酸的混合酸溶液平均分成两份。向其中一份中逐渐加入铜粉最多能溶解9.6g(假设此时硝酸只被还原为NO,下同);向另一份中逐渐加入铁粉,产生气体的量随铁粉质量的变化如图所示。则下列判断中错误的是( )
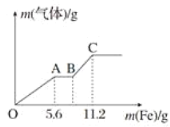
A.原混合酸溶液中H2SO4的浓度为2.0molL-1B.A点对应消耗NO3-物质的量为0.1mol
C.B点对应消耗铁粉的质量为8.4gD.OA段产生的气体是NO,BC段产生的气体是H2
【答案】A
【解析】
A.分析整个反应过程,最后溶液为FeSO4溶液,利用FeSO4中Fe原子与S原子相等,反应消耗Fe的总质量为11.2克,n(Fe)总=0.2mol,故n(H2SO4)=0.2mol,而混酸分成两份进行反应,所以溶液的体积为0.05L,故c(H2SO4)=4 mol·L-1,选项A错误;
B.由方程式Fe+4H++NO3-=Fe3++NO↑+2H2O,再根据消耗的铁为5.6克即铁的物质的量为0.1mol,可以求出消耗的NO3-为0.1mol,选项B正确;
C.由方程式2Fe3++Fe=3Fe2+利用Fe3+可求出生成的Fe2+为0.15mol,再根据Fe原子守恒n(Fe)=n(Fe2+)=0.15mol,所以消耗的铁粉为0.15mol×56g/mol=8.4g,选项C正确;
D.由图象可知Fe与混酸反应发生三个过程O→A为:Fe+4H++NO3-=Fe3++NO↑+2H2O,A→B为:2Fe3++Fe=3Fe2+,B→C为:Fe+2H+=Fe2++H2↑,选项D正确;
答案选A。


 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】下列化学用语的表达正确的是( )
A. 原子核内有10个中子的氧原子:![]() O
O
B. 氯原子的结构示意图:![]()
C. Fe3+的最外层电子排布式:3s23p63d5
D. 基态铜原子的外围电子轨道表示式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z为原子序数依次增大的短周期主族元素,其中Y元素在同周期中离子半径最小;甲、乙分别是元素Y、Z的单质;丙、 丁、戊是由W、X、Y、Z元素组成的二元化合物,常温下丁为液态;戊为酸性气体,常温下0.01mol·L-1戊溶液的pH大于2。上述物质转化关系如图所示。下列说法正确的是
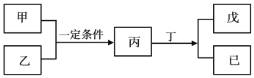
A.原子半径:Z>Y>X>W
B.W和X形成的化合物既可能含有极性键也可能含有非极性键
C.Z的氧化物对应的水化物均为强酸
D.简单氢化物的热稳定性:X<Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列生产或实验事实引出的结论不正确的是( )
选项 | 事实 | 结论 |
A | 其他条件相同,Na2S2O3溶液和H2SO4溶液反应,升高溶液的温度,析出硫沉淀所需时间缩短 | 当其他条件不变时,升高反应 温度,化学反应速率加快 |
B | 工业制硫酸过程中,在SO3的吸收阶段,吸收塔里要装填瓷环 | 增大气液接触面积,使SO3的吸收速率增大 |
C | 在容积可变的密闭容器中发生反应:2NH3(g) | 反应速率减慢 |
D | A.B两支试管中分别加入等体积5%的H2O2溶液,在B试管中加入2~3滴FeCl3溶液,B试管中产生气泡快 | 当其他条件不变时,催化剂可 以改变化学反应速率 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酶在生命活动和工业生产中都有很好的催化效果。有下列物质的转化关系:

请回答:
(1)E→F 的反应类型_______________;
(2)有机物 B、 C 都含有的官能团名称___________________;
(3)写出 C 与 F 在浓硫酸加热条件下发生反应的化学方程式__________________;
(4)写出C在一定条件下发生缩聚反应生成产物的结构简式____________________;
(5)写出与G含有相同官能团且能发生银镜反应的一种同分异构体______________;
(6)下列说法正确的是_______。
A.可以用 NaOH 溶液鉴别物质 B、C、D
B.等物质的量的C 和 D 分别与足量的钠反应,产生等物质的量的氢气
C.葡萄糖和E均可以发生银镜反应
D. 物质 F 一定条件下可以转化为 E,E也可以转化为D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为原电池装置示意图。
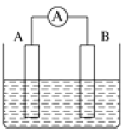
⑴将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,作负极的分别是___________(填字母)。
A.铝片、铜片 B.铜片、铝片 C.铝片、铝片 D.铜片、铜片
写出插入烧碱溶液中形成的原电池的负极反应式:________________。
⑵若A为Pb,B为PbO2,电解质为H2SO4溶液,工作时的总反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O。写出B电极反应式:________________;该电池在工作时,A电极的质量将___________(填“增加”“减小”或“不变”)。若该电池反应消耗了0.1mol H2SO4,则转移电子的数目为____________。
⑶若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入C3H8和O2,该电池即为丙烷燃料电池,写出B电极反应式:_________________;A极的反应物C3H8的一氯代物有__________种同分异构体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钠晶体为体心立方晶胞,实验测得钠的密度为ρ(g·cm-3)。已知钠的相对原子质量为a,阿伏加德罗常数为NA(mol-1),假定金属钠原子为等径的刚性小球且处于体对角线上的三个球相切。则钠原子的半径r(cm)为( )
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下发生反应2SO3(g)![]() 2SO2(g)+O2(g),将1molSO3气体通入1L容积恒定的密闭容器中,维持容器内温度不变,5min末测得SO3的物质的量为0.4mol。则下列说法正确的是( )
2SO2(g)+O2(g),将1molSO3气体通入1L容积恒定的密闭容器中,维持容器内温度不变,5min末测得SO3的物质的量为0.4mol。则下列说法正确的是( )
A. 0~5min,O2的生成速率v(O2)=0.06mol·L-1·min-1
B. 若起始时充入3molSO3,起始时SO3分解速率不变
C. 若某时刻消耗了0.5molSO3同时生成了0.25molO2,则表明该反应达到了平衡状态
D. 达到平衡时,SO2和SO3的浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
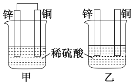
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的c(H+)均减小
D.产生气泡的速率甲比乙慢
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com