
【题目】酶在生命活动和工业生产中都有很好的催化效果。有下列物质的转化关系:

请回答:
(1)E→F 的反应类型_______________;
(2)有机物 B、 C 都含有的官能团名称___________________;
(3)写出 C 与 F 在浓硫酸加热条件下发生反应的化学方程式__________________;
(4)写出C在一定条件下发生缩聚反应生成产物的结构简式____________________;
(5)写出与G含有相同官能团且能发生银镜反应的一种同分异构体______________;
(6)下列说法正确的是_______。
A.可以用 NaOH 溶液鉴别物质 B、C、D
B.等物质的量的C 和 D 分别与足量的钠反应,产生等物质的量的氢气
C.葡萄糖和E均可以发生银镜反应
D. 物质 F 一定条件下可以转化为 E,E也可以转化为D
【答案】加成反应(还原反应) 羟基 ![]()
![]()
![]() CD
CD
【解析】
由B+C(C3H6O3)→G(CH3CH(OH)COOCH2CH3)发生酯化反应,逆推可知B是乙醇,C是2-羟基丙酸;葡萄糖在酒化酶的作用下反应生成乙醇和二氧化碳,则A为CO2;由E(CH2O)→F(CH4O)知E到F发生还原反应,推知E为甲醛(HCHO),F为甲醇(CH3OH),D为甲酸(HCOOH);以此分析解答。
综合以上分析,A为CO2,B为乙醇C2H5OH,C是2-羟基丙酸,D为甲酸(HCOOH),E为甲醛(HCHO),F为甲醇(CH3OH),
(1)由E(CH2O)→F(CH4O)知E到F发生还原反应,或加成反应;
故答案为:加成反应(还原反应);
(2)由B+C(C3H6O3)→G(CH3CH(OH)COOCH2CH3)逆推可知B是乙醇,C是2-羟基丙酸,所以B、C中都含有羟基,
故答案为:羟基;
(3)C是2-羟基丙酸,E是甲醇, C 与 F 在浓硫酸加热条件下发生酯化反应的化学方程式为 ![]() ,
,
故答案为:![]() ;
;
(4)C是2-羟基丙酸,C在一定条件下发生缩聚反应生成产物的结构简式为![]() ,
,
故答案为:![]() ;
;
(5)G为CH3CH(OH)COOCH2CH3,与G含有相同官能团且能发生银镜反应说明含有醛基,符合条件的同分异构体可以是:![]() 等;
等;
故答案为:![]() ;
;
(6)A.B为乙醇C2H5OH,C是2-羟基丙酸,D为甲酸(HCOOH),不能用 NaOH 溶液鉴别,故A错误;
B.C是2-羟基丙酸,D为甲酸(HCOOH),等物质的量的C 和 D 分别与足量的钠反应,产生氢气的物质的量不相等,故B错误;
C.E为甲醛(HCHO),葡萄糖和甲醛都含有醛基,均可以发生银镜反应,故C正确;
D. E为甲醛(HCHO),F为甲醇(CH3OH),一定条件下F可以转化为 E,E也可以转化为D,故D正确。
故答案为:CD。


科目:高中化学 来源: 题型:
【题目】下列我国科研成果所涉及材料中,主要成分为同主族元素形成的无机非金属材料的是
|
|
|
|
A.4.03米大口径碳化硅反射镜 | B.2022年冬奥会聚氨酯速滑服 | C.能屏蔽电磁波的碳包覆银纳米线 | D.“玉兔二号”钛合金筛网轮 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】意大利罗马大学的科学家获得了极具理论研究意义的N4分子,N4分子结构如图所示。下列有关N4的说法正确的是( )
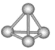
A. N4的沸点比N2低
B. N4分子中只含有非极性键,且键的夹角为109°28′
C. N4分子中每个氮原子都满足8个电子
D. 1mol N4中含有9 mol共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硅及其化合物的说法正确的是( )
A.陶瓷、玻璃、水泥容器都能贮存氢氟酸
B.硅酸钠属于盐,不属于碱,所以硅酸钠可以保存在具有磨口玻璃塞的试剂瓶中
C.用SiO2制取硅酸,应先使二氧化硅与氢氧化钠溶液反应,然后再通入CO2
D.由Na2CO3+SiO2![]() CO2↑+Na2SiO3可知,硅酸的酸性强于碳酸
CO2↑+Na2SiO3可知,硅酸的酸性强于碳酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究处理NOx、SO2,对环境保护有着重要的意义。回答下列问题:
(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。已知吸收过程中相关反应的热化学方程式如下:① SO2(g) + NH3H2O(aq) =NH4HSO3(aq) △H1 = a kJmol-1;② NH3H2O(aq) + NH4HSO3(aq) =(NH4)2SO3(aq) + H2O(l)△H2 = b kJmol-1;③ 2(NH4)2SO3(aq) + O2(g) =2(NH4)2SO4(aq) △H3= c kJmol-1,则反应 2SO2(g) + 4NH3H2O(aq) + O2(g) =2(NH4)2SO4(aq) + 2H2O(l) △H = ______。
(2)NOx的排放主要来自于汽车尾气,有人利用反应C (s) + 2NO(g)![]() N2(g) + CO2(g) △H=-34.0 kJmol-1,用活性炭对NO进行吸附。在恒压密闭容器中加入足量的活性炭和一定量的NO气体,测得NO的转化率 α(NO)随温度的变化如图所示:
N2(g) + CO2(g) △H=-34.0 kJmol-1,用活性炭对NO进行吸附。在恒压密闭容器中加入足量的活性炭和一定量的NO气体,测得NO的转化率 α(NO)随温度的变化如图所示:
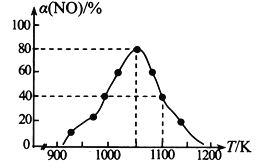
①由图可知,1050K前反应中NO的转化率随温度升高而增大,原因是_________________________; 在1100K 时,CO2的体积分数为______。
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa 时,该反应的化学平衡常数Kp=________(已知:气体分压=气体总压×体积分数)。
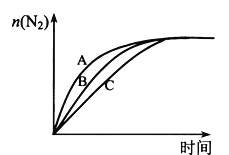
(3)在高效催化剂的作用下用CH4还原NO2,也可消除氮氧化物的污染。在相同条件下,选用A、B、C三种不同催化剂进行反应,生成 N2的物质的量与时间变化关系如图所示,其中活化能最小的是_________(填字母标号)。
(4)在汽车尾气的净化装置中 CO和NO发生反应:2NO(g) + 2CO(g)![]() N2(g) + 2CO2(g) △H2 =-746.8 kJmol-1。实验测得,υ正=k正c2(NO) c2(CO) ,υ逆=k逆c(N2) c2(CO2) (k正、k逆为速率常数,只与温度有关)。
N2(g) + 2CO2(g) △H2 =-746.8 kJmol-1。实验测得,υ正=k正c2(NO) c2(CO) ,υ逆=k逆c(N2) c2(CO2) (k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数_____(填" >”、“< ”或“=”) k逆增大的倍数。
②若在1L 的密闭容器中充入1 mol CO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则![]() =_____(保留2位有效数字)。
=_____(保留2位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将100mL稀硝酸和稀硫酸的混合酸溶液平均分成两份。向其中一份中逐渐加入铜粉最多能溶解9.6g(假设此时硝酸只被还原为NO,下同);向另一份中逐渐加入铁粉,产生气体的量随铁粉质量的变化如图所示。则下列判断中错误的是( )
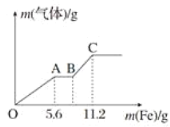
A.原混合酸溶液中H2SO4的浓度为2.0molL-1B.A点对应消耗NO3-物质的量为0.1mol
C.B点对应消耗铁粉的质量为8.4gD.OA段产生的气体是NO,BC段产生的气体是H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取100mL0.2mol/L的FeCl3溶液置于烧杯中,向其中加入一定量的Fe、Cu混合物,充分反应后仍有固体剩余,下列叙述一定正确的是( )(设溶液体积不变,不考虑水解因素)。
A.烧杯中有Fe无Cu,c(Fe2+)=0.2mol/L
B.烧杯中有Cu无Fe,c(Fe2+)=0.3mol/L
C.烧杯中有Cu无Fe,0.2mol/L![]() c(Fe2+)
c(Fe2+)![]() 0.3mol/L
0.3mol/L
D.烧杯中Fe、Cu均有,c(Fe2+)=0.3mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)元素周期表是我们研究物质性质、结构的重要工具,对周期表的熟悉和掌握程度直接影响我们对化学的学习。元素周期表共有七个周期十六个族;第ⅠA族元素(除氢外)的最高价氧化物对应水化物都是易溶于水的强碱,又称为___元素,卤族元素位于第__纵行,最高正价与最低负价的绝对值相等的元素位于___族。
(2)A、B、C、D、E、F、G为原子序数依次增大的前20号元素(此时不考虑稀有气体元素),在周期表中B和C,C和E分别相邻,B、E、G的最外层电子数之和为12。已知部分元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
A | 该元素有一种核素质量数为1 |
B | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
D | 原子的次外层电子数是最外层电子数的两倍 |
①由元素A、B形成的核外电子总数为10e-的两种微粒:___,___(写化学式)。
②C元素在周期中的位置:___。
③C、D形成的化合物在通讯上的重要用途___。
④E与G两元素可形成化合物,用电子式表示其化合物的形成过程:___。
⑤用化学方程式表示B、D两种元素的非金属性强弱___。
⑥A、B、F三种元素形成的一种常见化合物易溶于水,受热易分解,可用于制作干电池,该物质的电子式是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com