
【题目】下列图示变化为吸热反应的是
A.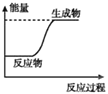
B.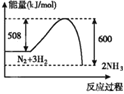
C.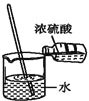
D.
【答案】A
【解析】
反应物的总能量大于生成物的总能量的反应为放热反应,反应物的总能量小于生成物的总能量的反应为吸热反应。常见的放热反应有:燃烧、金属与酸反应、金属与水反应、酸碱中和反应、铝热反应和绝大多数化合反应等;常见的吸热反应有:绝大数分解反应、某些化合反应(如碳与二氧化碳的反应)、碳与水蒸气的反应、氯化铵晶体与Ba(OH)2·8H2O的反应等。
A.图中反应物的总能量较低生成物的总能量较高,则该反应为吸热反应,A正确;
B.图中反应物的总能量较高生成物的总能量较低,则该反应为放热反应,B错误;
C.浓硫酸溶于水放热,但过程中没有发生化学变化,不符合题意,C错误;
D.活泼金属与酸的反应是放热反应,不符合题意,D错误;
故选A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下图是某学校实验室从化学试剂商店买同的硫酸试剂标签上的部分内容。据此下列说法正确的是
硫酸化学纯(CP)
(500mL)
品名:硫酸
化学式:H2SO4
相对分子质量:98
密度:1.84g / cm3
质量分数:98%
A.该硫酸的物质的量浓度为1.84mol/L
B.1mol Zn与足量的该硫酸反应产生2gH2
C.配制200mL 4.6mol/L的稀硫酸需取该硫酸50mL
D.该硫酸与等体积的水混合所得溶液的物质的量浓度等于9.2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇脱水是制取烯烃的常用方法,实验室以环己醇为原料制取环己烯的实验装置如图所示。
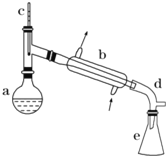
反应的化学方程式:
合成反应: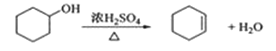
在a中加入40g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:
反应粗产物倒入分液漏斗中,分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯20g。
可能用到的有关数据如下:
相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
回答下列问题:
(1)装置b的名称是___________
(2)加入碎瓷片的作用是_________
(3)本实验中最容易产生的副反应的化学方程式为______________
(4)分离提纯过程中加入无水氯化钙的目的是________________
(5)本实验所得到的环己烯产率是____(填正确答案标号)
A.41% B.50% C.61% D.70%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酶在生命活动和工业生产中都有很好的催化效果。有下列物质的转化关系:

请回答:
(1)E→F 的反应类型_______________;
(2)有机物 B、 C 都含有的官能团名称___________________;
(3)写出 C 与 F 在浓硫酸加热条件下发生反应的化学方程式__________________;
(4)写出C在一定条件下发生缩聚反应生成产物的结构简式____________________;
(5)写出与G含有相同官能团且能发生银镜反应的一种同分异构体______________;
(6)下列说法正确的是_______。
A.可以用 NaOH 溶液鉴别物质 B、C、D
B.等物质的量的C 和 D 分别与足量的钠反应,产生等物质的量的氢气
C.葡萄糖和E均可以发生银镜反应
D. 物质 F 一定条件下可以转化为 E,E也可以转化为D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国Lawrece Liermore国家实验室(LINL)成功地在高压下将![]() 转化为具有类似
转化为具有类似![]() 结构的原子晶体,下列关于
结构的原子晶体,下列关于![]() 的原子晶体说法,正确的是:
的原子晶体说法,正确的是:
A. ![]() 的原子晶体和分子晶体互为同分异构体
的原子晶体和分子晶体互为同分异构体
B. 在一定条件下,![]() 原子晶体转化为
原子晶体转化为![]() 分子晶体是物理变化
分子晶体是物理变化
C. ![]() 的原子晶体和
的原子晶体和![]() 分子晶体具有相同的物理性质和化学性质
分子晶体具有相同的物理性质和化学性质
D. 在![]() 的原子晶体中,每一个C原子周围结合4个O原子,每一个O原子跟两个C原子相结合
的原子晶体中,每一个C原子周围结合4个O原子,每一个O原子跟两个C原子相结合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钠晶体为体心立方晶胞,实验测得钠的密度为ρ(g·cm-3)。已知钠的相对原子质量为a,阿伏加德罗常数为NA(mol-1),假定金属钠原子为等径的刚性小球且处于体对角线上的三个球相切。则钠原子的半径r(cm)为( )
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组进行了有关Cu、硝酸、硫酸化学性质的实验,实验过程如下图所示。下列有关说法正确的是
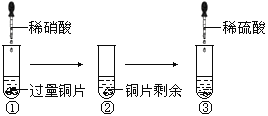
A. 实验①中溶液呈蓝色,试管口有红棕色气体产生,说明稀硝酸被Cu还原为NO2
B. 实验③中滴加稀硫酸,铜片继续溶解,说明稀硫酸的氧化性比稀硝酸强
C. 实验③发生反应的化学方程式为:3Cu+Cu(NO3)2+4H2SO4=4CuSO4+2NO↑+4H2O
D. 由上述实验可得出结论:Cu在常温下既可以和稀硝酸反应,也可以和稀硫酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是重要的有机化工原料,可由乙醇脱水制备。涉及反应如下:
①2CH3OH(g)![]() CH3OCH3(g)+ H2O(g) △H1=—23.9 kJmol-1
CH3OCH3(g)+ H2O(g) △H1=—23.9 kJmol-1
②2CH3OH(g)![]() C2H4(g)+2H2O(g) △H2= —29.1kJmol-1
C2H4(g)+2H2O(g) △H2= —29.1kJmol-1
③CH3CH2OH(g)![]() CH3OCH3(g) △H3= +50.7kJmol-1
CH3OCH3(g) △H3= +50.7kJmol-1
④C2H5OH(g)![]() C2H4(g)+ H2O(g) △H4=akJmol-1
C2H4(g)+ H2O(g) △H4=akJmol-1
回答下列问题:
(1)a=___________。
(2)在1.0L密闭容器中放入0.10 mol C2H5OH(g),在一定温度下进行④反应,反应时间(t)与容器内气体总压强(P)的数据见下表:
时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
总压强P/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
①欲提高C2H5OH的平衡转化率,应采取的措施为___________(填字母)。
a.升高温度 b.增大压强
c.通入乙醇 d.降低压强
②由总压强P和起始压强P0计算反应物C2H5OH的转化率(C2H5OH)的表达式为_________,平衡时C2H5OH的转化率为_______(结果保留两位有效数字,下同),该反应的平衡常数K=_________。
③用总压强P和起始压强P0表示反应体系的总物质的量n(总)和反应物C2H5OH的物 质的量n(C2H5OH),n(总)=_____mol,n(C2H5OH)=_____mol。
(3)下表为反应④中反应物浓度与反应时间的数据,分析该反应中c(C2H5OH)变化与时间间隔(△t)的规律,得出的结论是______,由此规律推出反应在12h时c(C2H5OH)等于______molL-1
反应时间t/h | 0 | 4 | 8 | 16 |
c(C2H5OH)/(molL-1) | 0.10 | 0.051 | 0.026 | 0.0065 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com