
����Ŀ��[��ѧһѡ��3:���ʽṹ������]̫���ܵ�ذ���ϳ���Ʒ���⣬���к�ͭ�������ء�����Ԫ�صĻ�ѧ���ʡ�
��1����̬��ԭ�ӵļ۵��ӹ������ʽ__________��
��2����һ���������л��軯����й��顣�������ɡ��ṹ����Ӧ���������ơ������й��ȡ________�ӻ���ʽ������ķе�����Է��������Ĺ�ϵ����ͼ��ʾ�����ֱ仯��ԭ����_________��

��3��������ͬΪVIA��Ԫ�أ��������ڵ�Ԫ��������壬������Ԫ�صĵ縺����С�����˳��Ϊ____________(��Ԫ�ط��ű�ʾ����
��4����̬SeO3���ӵ����幹��Ϊ_________����SeO3��Ϊ�ȵ������һ��������Ϊ_______(�ѧʽ)��
��5��CuCl��������Һ����CO�γ��Ȼ��ʻ���ͭ[CuCl(CO)2 H2O��ͨ���γɶ����壬�ṹʾ��ͼ���¡���û���������Cu+�γ���λ����ԭ����_________��

��6������ͭ��Ͻ�����������������ܶ��ṹ���ھ����н�ԭ��λ�ڶ��㣬ͭԭ��λ�����ģ���úϽ���ͭԭ��(Cu)���ԭ��(Au)������Ϊ____________�����þ���ľ����ⳤΪa nm����úϽ��ܶ�Ϊ____________(�г�����ʽ����Ҫ��������������ӏ�������ֵΪNA)
���𰸡���1��![]() ��2�֣���2��sp3��1�֣�����Ϊ��ɺͽṹ���Ƶķ��Ӿ��壬�������Է�������Խ���Ӽ䷶�»���Խǿ��2�֣���3��As<Se<Br��1�֣�
��2�֣���2��sp3��1�֣�����Ϊ��ɺͽṹ���Ƶķ��Ӿ��壬�������Է�������Խ���Ӽ䷶�»���Խǿ��2�֣���3��As<Se<Br��1�֣�
��4��ƽ�������Σ�1�֣�CO32-��NO3-��SiO32-��2�֣�
��5��C��O��Cl��6��3��1��2�֣�![]() ��2�֣�
��2�֣�
�������������������1������14��Ԫ�أ�����ԭ�Ӻ�������Ų����ɿ���д��������Ų�ʽΪ1s22s22p63s23p2����۵��ӹ������ʽΪ![]() ��
��
��2�����ݹ���ķ���ʽ�ó��������ͨʽΪSinH2n+2����������ɡ��ṹ����Ӧ���������ƣ����Թ����й��ȡsp3�ӻ���ʽ�����飨SinH2n+2�����Ƿ��Ӿ��壬���Ӿ���ķе�ߵ�ȡ���ڷ��Ӽ��������������Ӽ�����������Է��������Ĵ�С�йأ��������Է�������Խ���Ӽ䷶�»���Խǿ��
��3���顢����������Ԫ�ض��ǵ�4���ڷǽ���Ԫ�أ�ͬһ����Ԫ��������ҵ縺�Գ��������ƣ���縺��As��Se��Br��
��4����̬SeO3��������ԭ�ӵļ۲���Ӷ���Ϊ��6+0����2=3���µ��Ӷԣ����Է��ӹ���Ϊƽ�������Σ��ֵȵ�����Ҫ��ԭ��������ͬ���۵�������ͬ��������SeO3��Ϊ�ȵ������һ������ΪCO32-��NO3-��SiO32-��
��5���Ȼ��ʻ���ͭ[CuCl(CO)2 H2O�γɵĶ�����Ľṹʾ��ͼΪ![]() ����û���������Cu+�γ���λ����ԭ����C��O��Cl��
����û���������Cu+�γ���λ����ԭ����C��O��Cl��
��6���ھ����У�Auԭ��λ�ڶ��㣬Cuԭ��λ�����ģ��þ�����Auԭ�Ӹ���=8��1/8=1��Cuԭ�Ӹ���=6��1/2=3�����ԸúϽ���Cuԭ����Auԭ�Ӹ���֮��=3��1���������V=��a��10-10cm��3��ÿ��������ͭԭ�Ӹ�����3��Auԭ�Ӹ�����1������=![]() ��
��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס������������ڶ�����A��B�ķ�Ӧ����������ÿ���Ӽ���4 mol A����������ÿ���Ӽ���2 mol A����������ڵķ�Ӧ���ʱ��������ڵķ�Ӧ������ ��
A���� B���� C����� D�����ж�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���ҴӺ����Һ����H2O�⣬����CCl4��I2��I���ȣ��л��յ⣬��ʵ��������£�
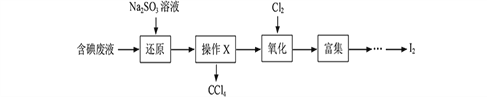
��1�����Һ�м����Թ�����Na2SO3��Һ������Һ�е�I2��ԭΪI���������ӷ���ʽΪ________________���ò�����I2��ԭΪI����Ŀ����_____________________��
��2������X������Ϊ____________��
��3������ʱ��������ƿ�н���I����ˮ��Һ���������pHԼΪ2������ͨ��Cl2����400C���ҷ�Ӧ��ʵ��װ������ͼ��ʾ����ʵ������ڽϵ��¶��½��е�ԭ����________________����ƿ��ʢ�ŵ���ҺΪ______________��

��4����֪��5SO32��+2IO3��+2H��![]() I2+5SO42��+H2O
I2+5SO42��+H2O
ij�����ˮ��pHԼΪ8����һ������I2�����ܴ���I����IO3���е�һ�ֻ����֡��벹���������麬���ˮ���Ƿ���IO3����ʵ�鷽����ʵ���пɹ�ѡ����Լ���ϡ���ᡢ������Һ��FeCl3��Һ��Na2SO3��Һ��ȡ���������ˮ��CCl4�����ȡ����Һ��ֱ��ˮ���õ�����Һ���鲻���ⵥ�ʴ��ڣ�_____________________________________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����г��ӷ�������ȷ����
A. ��ȥNH4Cl��Һ�е�FeCl3��������Һ�м��백ˮ����pH
B. ��ȥ��������Cu2+��Hg2+��������Һ�м���Na2S��H2S�ȳ�����
C. ��ȥij��Һ�е�SO42-������Һ�м���þ��
D. ��ȥZnCl2��Һ�е�Fe3+������Һ�м���Zn(OH)2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����л����У�ֻ��һ���Լ����������
A. �������ӡ���ϩ
B. �����ױ����ұ�
C. �Ҵ����ױ���������
D. �������ӡ����Ȼ�̼
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У���һ�������¼��ܷ����ӳɷ�Ӧ��Ҳ�ܷ���ȡ����Ӧ��������ʹKMnO4������Һ��ɫ����
A����ϩ B���� C�� �ױ� D����Ȳ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�� ��һ���¶������£������Ѵ�ƽ��ķ�Ӧ��FeCl3+3KSCN![]() 3KCl+Fe��SCN��3���ڴ���Һ�������´�����ƽ�����Ƶ����� ��
3KCl+Fe��SCN��3���ڴ���Һ�������´�����ƽ�����Ƶ����� ��
A�����������Ȼ��ع��� B�����������Ȼ�������
C��ֻ����Fe��SCN��3��Ũ�� D����ˮϡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������кܶ���Ҫ��Ӧ�á�
��1���Ŵ��Ĵ���֮һ�ĺڻ�ҩ������ǡ�ľ̿����__________��һ��������϶��ɡ�
��2������������Ҫ�ɷ���FeS2�����ڹ�ҵ��ȡ�������������ᾭ�����������Σ�
����һ�����������ĩͶ������¯��������ȼ�������������ȣ��䷴Ӧ�Ļ�ѧ����ʽΪ__________________������������_______________��
���ڶ�����������¯����S��������������֪6.4g SO2������ȫ����ΪSO3����ų�14.8kJ��������д������Ӧ���Ȼ�ѧ����ʽΪ________________________����ҵ�ϲ��ó�ѹ�����������SO3���ʵĴ�ʩ����______________________(д2�ּ���)
��3������������Na2SO3����������������ˮ��ȥ�ȼ���д��ȥ�ȣ�Cl2�������ӷ���ʽ��_____________��
��4����ˮ���������(Na2S2O3��5H2O)��һ����Ҫ������ԭ�ϡ���ҵ�ϵ�һ�����������ǽ�SO2ͨ����Na2S��Na2CO3���ض�������ɵĻ��Һ�в��������¶������з�Ӧ��Ȼ����һϵ�й����ᾧ�����д��SO2ͨ��Na2S��Na2CO3���Һ������Ӧ�Ļ�ѧ����ʽΪ_________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��д��ȷ����
A. ��Ͷ���Ȼ�������Һ�У�2Na��Fe2��===2Na����Fe
B. AlCl3��Һ�м�������İ�ˮ��Al3����3NH3��H2O===Al(OH)3����3NH4+
C. Fe3O4����ϡ�����У�Fe3O4��8H��===Fe2����2Fe3����4H2O ![]()
D. ����ʯ��ˮ�м��������NaHCO3��Һ��Ca2����OH����HCO3��===CaCO3����H2O
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com