
【题目】甲、乙两个容器内都进行A→B的反应,甲容器内每分钟减少4 mol A,乙容器内每分钟减少2 mol A,则甲容器内的反应速率比乙容器内的反应速率( )
A.快 B.慢 C.相等 D.无法判断
科目:高中化学 来源: 题型:
【题目】下列有关溶液组成的描述合理的是( )
A. 无色溶液中可能大量存在Al3+、NH4+、Cl、S2-
B. 酸性溶液中可能大量存在Na+、ClO、SO42、I-
C. 弱碱性溶液中可能大量存在Na+、K+、Cl、HCO3-
D. 中性溶液中可能大量存在Fe3+、K+、Cl、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 生铁、不锈钢和黄铜都属于合金
B. 淀粉、油脂和蛋白质都属于天然高分子化合物
C. 水泥、玻璃和陶瓷都属于无机非金属材料
D. 天然气、液化石油气和汽油的主要成分都属于径类
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定。
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)
2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表:
温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
平衡气体总浓度/mol·L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
①下列不能判断该分解反应已经达到平衡的是________。
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
E.闭容器中混合气体的平均相对分子质量不变
②用某气体组分(B)的平衡压强(pB)代替气体组分(B)的物质的量浓度(cB)也可以表示平衡常数(记作KP),气体组分(B)的平衡压强(pB)等于混合气体的总压乘以该气体的物质的量分数。根据表中数据,计算 25.0 ℃时氨基甲酸铵分解的平衡常数Kp=_____ ___。
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在 25.0 ℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量_________(填“增加”、“减少”或“不变”)。
④氨基甲酸铵分解反应的焓变ΔH_________0(填“>”、“=”或“<”),熵变ΔS_________0(填“>”、“=”或“<”)。
(2)已知:NH2COONH4+2H2O![]() NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定其水解反应速率,得到c(NH2COO-)随时间的变化趋势如图所示。
NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定其水解反应速率,得到c(NH2COO-)随时间的变化趋势如图所示。
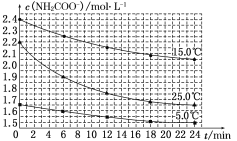
⑤计算 25.0 ℃时,0~6 min 氨基甲酸铵水解反应的平均速率:____________。
⑥根据图中信息,如何说明该水解反应速率随温度升高而增大:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气(含CO、SO2和NO等)是城市空气污染源之一,治理的方法之一是在汽车的排气管上装一个“催化转化器”,它能使一氧化碳跟一氧化氮反应生成可参与大气生态循环的无毒气体,并促进二氧化硫的转化。
(1)汽车尾气中导致酸雨形成的主要物质是____ ____。
(2)写出在催化剂的作用下CO跟NO反应的化学方程式:_______ ________。
(3)使用“催化转化器”的缺点是在一定程度上提高了排放废气的酸度,有可能促进了酸雨的形成,其原因是 。
(4)下列各项措施中,有利于缓解城市空气污染的有________(填序号)。
A.充分利用太阳能,减少能源消耗
B.使用电动车辆,减少汽油消耗
C.植树种草,绿化环境
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列烷烃的沸点是:乙烷-88℃、丙烷-42.1℃、正丁烷-0.5℃、戊烷36.1℃,根据以上数据推断异丁烷的沸点可能是
A.大约-12℃ B.低于-42.1℃ C.高于36.1℃ D.高于-0.5℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲和乙的某些性质如下表所示:
物质 | 熔点(℃) | 沸点(℃) | 密度(g·mL-1) | 溶解性 |
甲 | -98 | 37.5 | 0.93 | 可溶 |
乙 | -48 | 95 | 0.90 | 可溶 |
现有甲和乙的混合物,进行分离时,可采用的方法是( )
A.蒸馏 B.蒸发 C.过滤 D.萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一选修3:物质结构与性质]太阳能电池板材料除单品硅外,还有含铜、铟、镓、硒等元素的化学物质。
(1)基态硅原子的价电子轨道表达式__________。
(2)有一类组成最简单的有机硅化合物叫硅烷。硅烷的组成、结构与相应的烷烃相似。硅烷中硅采取________杂化方式,硅烷的沸点与相对分子质量的关系如下图所示现这种变化的原因是_________。

(3)硒和硫同为VIA族元素,与其相邻的元素有砷和溴,则三种元素的电负性由小到大的顺序为____________(用元素符号表示)。
(4)气态SeO3分子的立体构型为_________,与SeO3互为等电子体的一种阴离子为_______(填化学式)。
(5)CuCl的盐酸溶液吸收CO形成氯化羰基亚铜[CuCl(CO)2 H2O,通常形成二聚体,结构示意图如下。则该化合物中与Cu+形成配位键的原子是_________。

(6)—种铜金合金晶体具有面心立方最密堆枳结构,在晶胞中金原子位于顶点,铜原子位于面心,则该合金中铜原子(Cu)与金原子(Au)个数比为____________,若该晶体的晶胞棱长为a nm,则该合金密度为____________(列出计算式,不要求计算结果,阿伏加徳罗常数的值为NA)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com