
【题目】某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定。
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)
2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表:
温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
平衡气体总浓度/mol·L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
①下列不能判断该分解反应已经达到平衡的是________。
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
E.闭容器中混合气体的平均相对分子质量不变
②用某气体组分(B)的平衡压强(pB)代替气体组分(B)的物质的量浓度(cB)也可以表示平衡常数(记作KP),气体组分(B)的平衡压强(pB)等于混合气体的总压乘以该气体的物质的量分数。根据表中数据,计算 25.0 ℃时氨基甲酸铵分解的平衡常数Kp=_____ ___。
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在 25.0 ℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量_________(填“增加”、“减少”或“不变”)。
④氨基甲酸铵分解反应的焓变ΔH_________0(填“>”、“=”或“<”),熵变ΔS_________0(填“>”、“=”或“<”)。
(2)已知:NH2COONH4+2H2O![]() NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定其水解反应速率,得到c(NH2COO-)随时间的变化趋势如图所示。
NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定其水解反应速率,得到c(NH2COO-)随时间的变化趋势如图所示。
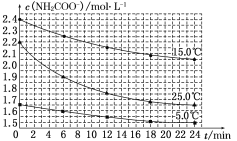
⑤计算 25.0 ℃时,0~6 min 氨基甲酸铵水解反应的平均速率:____________。
⑥根据图中信息,如何说明该水解反应速率随温度升高而增大:_______________。
【答案】(1)①ADE ②256(kPa)3 ③增加
④> > (2)⑤0.05 mol·L-1·min-1
⑥25.0℃时反应物的起始浓度较小,但 0~6 min的平均反应速率(曲线的斜率)仍比15.0℃时的大
【解析】
试题分析:①A.2v(NH3)═v(CO2),不能说明正逆反应速率相等,不一定是平衡状态,A错误;B.反应是一个前后系数和变化的反应,密闭容器中总压强不变,证明达到了平衡状态,B正确;C.密闭容器中混合气体的密度ρ=m/V,质量不守恒,分子变化,V不变,容器中总密度不变,证明达到了平衡状态,C正确;D.密闭容器中氨气的体积分数不变,不能证明达到平恒状态,D错误;E.体系中只有氨气和二氧化碳,且二者的组成固定,因此闭容器中混合气体的平均相对分子质量始终不变,E错误,答案选ADE;
②体系中氨气和CO2的体积之比是2:1,25℃平衡混合气体的压强为12kPa,其中氨气是8kPa,CO2是4kPa,所以25.0 ℃时氨基甲酸铵分解的平衡常数Kp=(8kPa)2×4kPa=256(kPa)3;
③若在恒温下压缩容器体积,则会将压强增大,平衡向左移动,固体质量增加;
④根据表中的数据分析:温度越高,则平衡气体的总浓度越大,所以升高温度,平衡正向移动,反应是吸热的,反应物是固体,产物是气体,该反应是熵增加的过程,即△H>0;
⑤化学反应速率V=△c/△t=( 2.2mol/L1.9mol/L)/6min=0.05mol/(Lmin);
⑥因25℃反应物起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大。


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式是( )
A.金属铝溶于稀硫酸中:Al+2H+===Al3++H2↑
B.碳酸锌溶于稀硝酸中:CO+2H+===H2O+CO2↑
C.醋酸钠水溶液中通入足量CO2: 2CH3COO-+CO2+H2O===2CH3COOH+CO
D.H2SO4与Ba(OH)2溶液反应: Ba2++2OH-+2H++SO===BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可产生NH3,请回答下列问题:
①较Na3N中两种微粒的半径r(Na+) r(N3-) (填“>”“<”或“=”),
②a3N与水反应属于 反应(填“氧化还原”或“非氧化还原”);
③酸反应生成两种盐的化学式为 ;
④写出化合物Na3N的电子式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液可能含I-、NH4+、Cu2+、SO32-中的若干种,向溶液中加入少量溴水,溶液仍呈无色,则下列关于溶液组成的判断正确的是
①肯定不含I- ②肯定不含Cu2+ ③肯定含有SO32- ④可能含有I— ⑤可能含有SO32-
A. ②③④ B. ②④⑤ C. ①②⑤ D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两个容器内都进行A→B的反应,甲容器内每分钟减少4 mol A,乙容器内每分钟减少2 mol A,则甲容器内的反应速率比乙容器内的反应速率( )
A.快 B.慢 C.相等 D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生研究小组欲探究CuSO4溶液与Na2CO3溶液混合产生的蓝绿色沉淀组成,小组进行下列实验探究。
【提出假设】
假设1:沉淀为Cu(OH)2;
假设2:所得沉淀为_ ;
假设3:所得沉淀为碱式碳酸铜[化学式可表示为nCu(OH)2·mCuCO3]。
【查阅资料】无论是哪一种沉淀受热均易分解(假设均不含结晶水)。
【物质成分探究】
步骤1:将所得悬浊液过滤,用蒸馏水洗涤,再用无水乙醇洗涤;
步骤2:甲同学取一定量所得固体,用气密性良好的如图装置(夹持仪器未画出)进行定性实验。[
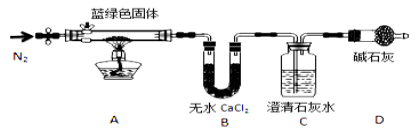
请回答下列问题:
(1)假设2中的沉淀是为 。
(2)假设1中沉淀为Cu(OH)2的理论依据是 。
(3)无水乙醇洗涤的目的 。
(4)若反应后A中蓝绿色固体变黑,C中无明显现象,证明假设__________(填写序号)成立。
(5)乙同学认为只要将上图中B装置的试剂改用___________试剂后,便可验证上述所有假设。
(6)乙同学更换B试剂后验证假设3成立的实验现象是_____ ____。
(7)在假设3成立的前提下,某同学考虑用Ba(OH)2代替Ca(OH)2,测定蓝绿色固体的化学式,若所取蓝绿色固体质量为27.1g,实验结束后装置B的质量增加2.7g,C中的产生沉淀的质量为19.7g。则该蓝绿色固体的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以 H2、O2、熔融盐 Na2CO3 组成燃料电池,采用电解法制备 Fe(OH)2,装置如下图所示,其中 P端通入CO2。通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色。则下列说法中正确的是

A.X、Y 两端都必须用铁作电极
B.不可以用 NaOH 溶液作为电解液
C.阴极发生的反应是:2H2O+2e-=H2↑+ 2OH-
D.X 端为电解池的阳极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com