
【题目】氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可产生NH3,请回答下列问题:
①较Na3N中两种微粒的半径r(Na+) r(N3-) (填“>”“<”或“=”),
②a3N与水反应属于 反应(填“氧化还原”或“非氧化还原”);
③酸反应生成两种盐的化学式为 ;
④写出化合物Na3N的电子式: 。
科目:高中化学 来源: 题型:
【题目】下列离子方程式中正确的是( )
A.碳酸钠溶液与石灰乳的反应: CO+Ca2+===CaCO3↓
B.硝酸银溶液与食盐水的反应: Ag++Cl-===AgCl↓
C.锌与盐酸的反应: Zn+2H++2Cl-===Zn2++2Cl-+H2↑
D.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体: Fe3++3H2OFe(OH)3↓+3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是________
A. KMnO4 B. H2O2 C. Cl2 水 D. HNO3
然后再加入适当物质调整至溶液pH=5,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的__________
A. NaOH B. CuO C. NH3·H2O D. Cu(OH)2
(2)甲同学怀疑调整至溶液pH=5是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为___________,Fe3+完全沉淀时溶液的pH为___________,通过计算确定上述方案___________(填“可行”或“不可行”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将pH=1的稀硫酸慢慢加入—定量的BaCl2的溶液中,恰好使Ba2+沉淀完全,此时溶液的体积为100 mL(混合时溶液体积的变化忽略不计),且混合溶液的pH=2,则原BaCl2溶液中Cl-的浓度约为
A.0.011 mol/L B.0.22 mol/L
C.0.022 mol/L D.0.11 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 生铁、不锈钢和黄铜都属于合金
B. 淀粉、油脂和蛋白质都属于天然高分子化合物
C. 水泥、玻璃和陶瓷都属于无机非金属材料
D. 天然气、液化石油气和汽油的主要成分都属于径类
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定。
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)
2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表:
温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
平衡气体总浓度/mol·L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
①下列不能判断该分解反应已经达到平衡的是________。
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
E.闭容器中混合气体的平均相对分子质量不变
②用某气体组分(B)的平衡压强(pB)代替气体组分(B)的物质的量浓度(cB)也可以表示平衡常数(记作KP),气体组分(B)的平衡压强(pB)等于混合气体的总压乘以该气体的物质的量分数。根据表中数据,计算 25.0 ℃时氨基甲酸铵分解的平衡常数Kp=_____ ___。
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在 25.0 ℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量_________(填“增加”、“减少”或“不变”)。
④氨基甲酸铵分解反应的焓变ΔH_________0(填“>”、“=”或“<”),熵变ΔS_________0(填“>”、“=”或“<”)。
(2)已知:NH2COONH4+2H2O![]() NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定其水解反应速率,得到c(NH2COO-)随时间的变化趋势如图所示。
NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定其水解反应速率,得到c(NH2COO-)随时间的变化趋势如图所示。
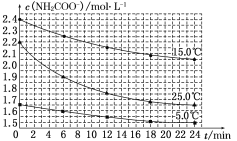
⑤计算 25.0 ℃时,0~6 min 氨基甲酸铵水解反应的平均速率:____________。
⑥根据图中信息,如何说明该水解反应速率随温度升高而增大:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列烷烃的沸点是:乙烷-88℃、丙烷-42.1℃、正丁烷-0.5℃、戊烷36.1℃,根据以上数据推断异丁烷的沸点可能是
A.大约-12℃ B.低于-42.1℃ C.高于36.1℃ D.高于-0.5℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质分类是化学研究的重要方法之一。化学工作者经常根据物质的组成对物质进行分类研究。近年来发现,在金星大气层中存在三氧化二碳。下列物质与它属于同类的是( )
A.H2、O3
B.H2SO4、H2CO3
C.SO2、NO
D.Na2SO3、KClO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com