
【题目】Na2CO3溶液滴入到下列物质的水溶液能产生CO2气体的是
A. NaOH B. NH4HSO4
C. HClO D. CaCl2
科目:高中化学 来源: 题型:
【题目】我国及美国、日本等国家都已研制出了一种陶瓷柴油机,这种柴油机的发动机部件的受热面是用一种耐高温且不易传热的材料来制造的,这种材料是 ( )
A.普通硅酸盐陶瓷 B.氮化硅陶瓷 C.光导纤维 D.玻璃钢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】瓦斯爆炸是煤矿开采中的重大危害,一种瓦斯分析仪(图甲)能够在煤矿巷道中的甲烷浓度达到一定浓度时,可以通过传感器显示.该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图乙所示,其中的固体电解质是Y2O3﹣Na2O,O2﹣可以在其中自由移动.
下列有关叙述正确的是( )

A. 电极a的反应式为:CH4+4O2﹣﹣8e﹣=CO2+2H2O
B. 电极b是正极,O2﹣由电极a流向电极b
C. 瓦斯分析仪工作时,电池内电路中电子由电极 a流向电极b
D. 当固体电解质中有2 mol O2﹣通过时,外电路通过电子8 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中正确的是( )
A.碳酸钠溶液与石灰乳的反应: CO+Ca2+===CaCO3↓
B.硝酸银溶液与食盐水的反应: Ag++Cl-===AgCl↓
C.锌与盐酸的反应: Zn+2H++2Cl-===Zn2++2Cl-+H2↑
D.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体: Fe3++3H2OFe(OH)3↓+3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门实用的中心学科,我们的生活离不开化学,下列有关说法中不正确的是( )
A.甘蔗渣可经化学反应制得酒精
B.棉花、蚕丝和人造丝的主要成分都是纤维素
C.厨房里洗涤油污,常用碱性洗涤剂,因为植物油会在碱性溶液中水解
D.不能用米汤检验食用碘盐中的碘酸钾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关溶液组成的描述合理的是( )
A. 无色溶液中可能大量存在Al3+、NH4+、Cl、S2-
B. 酸性溶液中可能大量存在Na+、ClO、SO42、I-
C. 弱碱性溶液中可能大量存在Na+、K+、Cl、HCO3-
D. 中性溶液中可能大量存在Fe3+、K+、Cl、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性的透明溶液中可能含有下列微粒中的几种。
阴离子:MnO4-、SiO32-、CO32-、I-、ClO-、SO32-
阳离子:Fe3+、Fe2+、NH4+、Ag+、Al3+、K+
分子: H2SO3
取该溶液进行以下连续实验。
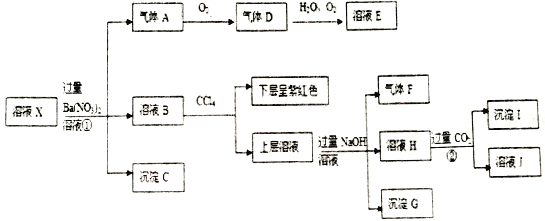
根据以上信息,回答下列问题:
(1)根据“强酸性的透明溶液”可知溶液中不含有的微粒是__________________;
(2)沉淀I的化学式为_____________;
(3)X溶液中,除H+、Al3+外还肯定含有的微粒是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是________
A. KMnO4 B. H2O2 C. Cl2 水 D. HNO3
然后再加入适当物质调整至溶液pH=5,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的__________
A. NaOH B. CuO C. NH3·H2O D. Cu(OH)2
(2)甲同学怀疑调整至溶液pH=5是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为___________,Fe3+完全沉淀时溶液的pH为___________,通过计算确定上述方案___________(填“可行”或“不可行”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定。
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)
2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表:
温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
平衡气体总浓度/mol·L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
①下列不能判断该分解反应已经达到平衡的是________。
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
E.闭容器中混合气体的平均相对分子质量不变
②用某气体组分(B)的平衡压强(pB)代替气体组分(B)的物质的量浓度(cB)也可以表示平衡常数(记作KP),气体组分(B)的平衡压强(pB)等于混合气体的总压乘以该气体的物质的量分数。根据表中数据,计算 25.0 ℃时氨基甲酸铵分解的平衡常数Kp=_____ ___。
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在 25.0 ℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量_________(填“增加”、“减少”或“不变”)。
④氨基甲酸铵分解反应的焓变ΔH_________0(填“>”、“=”或“<”),熵变ΔS_________0(填“>”、“=”或“<”)。
(2)已知:NH2COONH4+2H2O![]() NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定其水解反应速率,得到c(NH2COO-)随时间的变化趋势如图所示。
NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定其水解反应速率,得到c(NH2COO-)随时间的变化趋势如图所示。
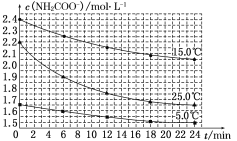
⑤计算 25.0 ℃时,0~6 min 氨基甲酸铵水解反应的平均速率:____________。
⑥根据图中信息,如何说明该水解反应速率随温度升高而增大:_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com