
【题目】下列有关溶液组成的描述合理的是( )
A. 无色溶液中可能大量存在Al3+、NH4+、Cl、S2-
B. 酸性溶液中可能大量存在Na+、ClO、SO42、I-
C. 弱碱性溶液中可能大量存在Na+、K+、Cl、HCO3-
D. 中性溶液中可能大量存在Fe3+、K+、Cl、SO42-
科目:高中化学 来源: 题型:
【题目】为探究某铁碳合金与浓硫酸在加热条件下的反应的部分产物并测定铁碳合金中铁元素的质量分数,某化学活动小组设计了如图所示的实验装置,并完成以下实验探究。

(1)往圆底烧瓶中加入m g铁碳合金,并滴入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:①常温下碳与浓硫酸不反应;② 。
(2)点燃酒精灯,反应一段时间后,从A中逸出气体的速率仍然较快,除因反应温度较高外,还可能的原因是 。
(3)装置B的作用是 。
(4)甲同学观察到装置C中有白色沉淀生成,他得出了使澄清石灰水变浑浊的气体是二氧化碳。装置A中能产生二氧化碳的化学方程式为 。
(5)乙同学认为甲同学的结论是错误的,他认为为了确认二氧化碳的存在,需在装置B-C之间添加装置M。装置E、F中盛放的试剂分别是 、 。重新实验后观察到装置F中的现象是 。
(6)有些同学认为合金中铁元素的质量分数可用KMnO4溶液来测定。(5Fe2+ + MnO4- + 8H+=5Fe3+ + Mn2+ + 4H2O)。测定铁元素质量分数的实验步骤如下:
Ⅰ.往烧瓶A中加入过量铜使溶液中的Fe3+完全转化为Fe2+,过滤,得到滤液B;
Ⅱ.将滤液B稀释为250mL;
Ⅲ.取稀释液25.00mL,用浓度为c mol·L-1的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体积的平均值为V mL。
① 步骤Ⅱ中,将滤液B稀释为250mL需要用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还必须要用到的是 。
② 判断滴定终点的标志是 。
③ 铁碳合金中铁元素的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 用胆矾炼铜、烧结粘土制陶瓷都涉及化学变化
B. 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈
C. 食盐、醋酸、氨水和硫酸钡都是电解质
D. 胶体区别其它分散系的本质特征是分散质微粒直径在1nm~100nm之间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在日常生活中出现了“加碘食盐”“增铁酱油”“高钙牛奶”“富硒茶叶”“含氟牙膏”等名词,这里的碘、铁、钙、硒、氟应理解为( )
A、元素 B、单质 C、分子 D、氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
I.已知:NO2(g)+SO2(g) ![]() SO3(g)+NO(g)
SO3(g)+NO(g)
(1)一定条件下,将NO2与SO2以体积比1:2置于恒容密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO2和NO2的体积比保持不变 d.每消耗1 mol SO3的同时生成1 molNO2
e.气体密度保持不变
(2)若保持体积不变,升高温度,体系颜色加深,则说明该反应的H________0(填”>””<”或”=”)
II.对于反应2SO2(g)+O2(g)![]() 2SO3(g);ΔH=-196.6kJ/mol。
2SO3(g);ΔH=-196.6kJ/mol。
在一定温度下,向一个容积不变的容器中,通入3mol SO2和2mol O2及固体催化剂,使之反应。平衡时容器内气体压强为起始时的90%。此时
(3)加入3mol SO2和2mol O2发生反应,达到平衡时,放出的热量为 。
(4)保持同一温度,在相同的容器中,将起始物质的量改为amol SO2、bmol O2、cmol SO3(g)及固体催化剂,欲使起始时反应表现为向正反应方向进行,且平衡时SO3的体积分数为2/9,a的取值范围是 。
(5)保持同一温度,在相同容器中,将起始物质的量改为3mol SO2、6mol O2、3mol SO3(g)及固体催化剂,则平衡_________移动。(填“正向、不、逆向或无法确定是否”)
(6)某SO2(g)和O2(g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图2所示,若不改变SO2(g)和O2(g)的量,则图中t4时引起平衡移动的条件可能是__________;图中表示平衡混合物中SO3的含量最高的一段时间是____________。
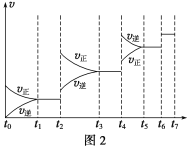
(7)各阶段平衡时对应的平衡常数如下表所示:
t1~t2 | t3~t4 | t5~t6 | t6~t7 |
K1 | K2 | K3 | K4 |
K1、K2、K3、K4之间的关系为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA是阿伏加德罗常数的值,下列说法正确的是
A.7g分子式为CnH2n的链烃中含有的C—H键的数目为NA
B.标准状况下,2.24 L CHCl3分子中共价键的数目为0.4NA
C.一定温度下,l L l mol·L-1的CH3COONa溶液含NA个CH3COO—离子
D.1 mol SO2与足量O2在一定条件下反应生成SO3的数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数,下列说法正确的是
A. 标准状况下,22.4L乙醇所含的分子数必定为NA
B. 1 mol NO2与足量的水反应,转移的电子数为2NA
C. 0.1molFe粉与足量水蒸气反应生成的H2分子数为0.15NA
D. 在常温常压下32g氧气所含的原子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两个容器内都进行A→B的反应,甲容器内每分钟减少4 mol A,乙容器内每分钟减少2 mol A,则甲容器内的反应速率比乙容器内的反应速率( )
A.快 B.慢 C.相等 D.无法判断
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com