
【题目】研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
I.已知:NO2(g)+SO2(g) ![]() SO3(g)+NO(g)
SO3(g)+NO(g)
(1)一定条件下,将NO2与SO2以体积比1:2置于恒容密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO2和NO2的体积比保持不变 d.每消耗1 mol SO3的同时生成1 molNO2
e.气体密度保持不变
(2)若保持体积不变,升高温度,体系颜色加深,则说明该反应的H________0(填”>””<”或”=”)
II.对于反应2SO2(g)+O2(g)![]() 2SO3(g);ΔH=-196.6kJ/mol。
2SO3(g);ΔH=-196.6kJ/mol。
在一定温度下,向一个容积不变的容器中,通入3mol SO2和2mol O2及固体催化剂,使之反应。平衡时容器内气体压强为起始时的90%。此时
(3)加入3mol SO2和2mol O2发生反应,达到平衡时,放出的热量为 。
(4)保持同一温度,在相同的容器中,将起始物质的量改为amol SO2、bmol O2、cmol SO3(g)及固体催化剂,欲使起始时反应表现为向正反应方向进行,且平衡时SO3的体积分数为2/9,a的取值范围是 。
(5)保持同一温度,在相同容器中,将起始物质的量改为3mol SO2、6mol O2、3mol SO3(g)及固体催化剂,则平衡_________移动。(填“正向、不、逆向或无法确定是否”)
(6)某SO2(g)和O2(g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图2所示,若不改变SO2(g)和O2(g)的量,则图中t4时引起平衡移动的条件可能是__________;图中表示平衡混合物中SO3的含量最高的一段时间是____________。
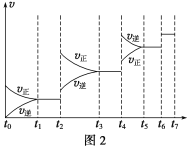
(7)各阶段平衡时对应的平衡常数如下表所示:
t1~t2 | t3~t4 | t5~t6 | t6~t7 |
K1 | K2 | K3 | K4 |
K1、K2、K3、K4之间的关系为__________________。
【答案】
(1)bc;(2)<;(3)98.3kJ;
(4)2<a≤3(5)不;
(6)升温;t3-t4(7)k1=k2>k3=k4
【解析】
试题分析:I.(1) a.无论是否达到平衡,体系压强都保持不变,不能用于判断是否达到平衡状态,故a错误;b.混合气体颜色保持不变,说明浓度不变,达到平衡状态,故b正确;c.开始时NO2与SO2的体积比1:2,随着反应的进行,NO2与SO2的体积比发生变化,当SO2和NO2的体积比保持不变时,说明达到了平衡状态,故c正确;d.物质的量之比等于化学计量数之比,则每消耗1mol SO3的同时生成1molNO2,不能判断是否达到平衡状态,故d错误;e.该反应的反应物和生成物全部为气体,容器内气体的质量始终不变,容器的体积不变,则气体密度始终保持不变,不能用于判断是否达到平衡状态,故e错误;故选bc;
(2)若保持体积不变,升高温度,体系颜色加深,说明平衡逆向移动,说明该反应的正反应为放热反应,H<0,故答案为:<;
II. (3)由题意气体压强为起使时的90%,则反应后总的物质的量为起使时的90%,平衡时总物质的量为(3mol+2mol)×90%=4.5mol,则平衡时各组成物质的量变化为:
2SO2+O2![]() 2SO3 物质的量减少△n
2SO3 物质的量减少△n
2 1 2 1
1mol 0.5mol 1mol (3mol+2mol)-4.5mol=0.5mol
此时放出的热量为196.6KJ×![]() =98.3KJ,故答案为:98.3;
=98.3KJ,故答案为:98.3;
(2)原平衡时SO3的体积分数为![]() =
=![]() ,将起始物质的量改为amol SO2、bmol O2、cmol SO3(g)及固体催化剂,平衡时SO3的体积分数为
,将起始物质的量改为amol SO2、bmol O2、cmol SO3(g)及固体催化剂,平衡时SO3的体积分数为![]() ,则与原平衡为等效平衡,则a+c=3 b+0.5c=2,由(1)计算可知,平衡时二氧化硫的物质的量为3mol-1mol=2mol,欲使起始时反应表现为向正反应方向进行,则2<a≤3,故答案为:2<a≤3;
,则与原平衡为等效平衡,则a+c=3 b+0.5c=2,由(1)计算可知,平衡时二氧化硫的物质的量为3mol-1mol=2mol,欲使起始时反应表现为向正反应方向进行,则2<a≤3,故答案为:2<a≤3;
(3)由题意气体压强为起使时的90%,则反应后总的物质的量为起使时的90%,平衡时总物质的量为(3mol+2mol)×90%=4.5mol,则平衡时各组成物质的量变化为:
2SO2+O2![]() 2SO3
2SO3
开始(mol):3 2 0
变化(mol):1 0.5 1
平衡(mol):2 1.5 1
假定体积为VL,则k=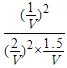 =
=![]() ,将起始物质的量改为3mol SO2、6mol O2、3mol SO3(g)及固体催化剂,此时的浓度商Qc=
,将起始物质的量改为3mol SO2、6mol O2、3mol SO3(g)及固体催化剂,此时的浓度商Qc= =
=![]() ,等于平衡常数,处于平衡状态,平衡不移动,故答案为:不;
,等于平衡常数,处于平衡状态,平衡不移动,故答案为:不;
(6) t2~t3段正逆速率都加快,且v(正)>v(逆),平衡正向移动,t4~t5段正逆速率都加快,且v(正)<v(逆),平衡逆向移动,该反应为体积减小的放热反应,若升高温度,平衡逆向移动,若增大压强,平衡正向移动,故t2~t3段为增大压强,t4~t5段为升高温度;t2~t3段为增大压强后,平衡正向移动,SO3的含量升高,至t3~t4平衡时含量达最高,故答案为:升高温度;t3~t4 ;
(7)根据上述分析,t2~t3段为增大压强,t4~t5段为升高温度,t6~t7段为为加入催化剂,平衡常数K只与温度有关,该反应为放热反应,升高温度,平衡逆向移动,K减小,因此k1=k2>k3=k4,故答案为:k1=k2>k3=k4。


科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关,下列叙述正确的是( )
A. 由于铝的熔点较低,用铝制容器烧水容器会很快熔化
B. 硝酸铵既可用作化肥,也可用于制炸药
C. 氨基酸是一类分子中都含有-COOH和-NH2的高分子化合物的统称
D. 石油是混合物,可通过分馏得到汽油、煤油等纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 过氧化钠投入到水中:2Na2O2+2H2O=4Na++4OH-+ O2↑
B. 氯化铵溶液与浓NaOH 溶液加热:NH4++OH-=NH3·H2O
C. 氯化铝溶液中滴入过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3 NH4+
D. 实验室制取氯气:MnO2+4HCl![]() Mn2++Cl2↑+2Cl-+2H2O
Mn2++Cl2↑+2Cl-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关溶液组成的描述合理的是( )
A. 无色溶液中可能大量存在Al3+、NH4+、Cl、S2-
B. 酸性溶液中可能大量存在Na+、ClO、SO42、I-
C. 弱碱性溶液中可能大量存在Na+、K+、Cl、HCO3-
D. 中性溶液中可能大量存在Fe3+、K+、Cl、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH3COOH为常见的弱酸,在工业生产和生活中有广泛的应用。
I.(1)常温下中和100 mL pH=3的CH3COOH溶液和1 L pH=4的CH3COOH溶液,需要等物质的量浓度的NaOH溶液的体积分别为V1和V2,则V1_______V2(填“>”、“=”或“<”)。
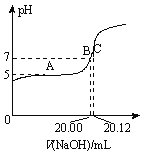
(2)常温下,用0.1000 mol/L的NaOH溶液滴定20.00 mL某未知浓度的CH3COOH溶液,滴定曲线如图所示。其中A点所示溶液中c(CH3COO-)=2c(CH3COOH),C点所示溶液中存在c(CH3COO-)+c(CH3COOH)=c(Na+)。则常温下CH3COOH的电离常数Ka=_________,CH3COOH溶液的实际浓度为____________。
Ⅱ.1100℃时,体积为2 L的恒容容器中发生如下反应:
Na2SO4(s)+4H2(g)![]() Na2S(s)+4H2O(g)。
Na2S(s)+4H2O(g)。
(1)下列能判断反应达到平衡状态的是________。
A.容器中压强不变
B.混合气体密度不变
C.1 mol H-H键断裂同时形成2 mol H-O
D.H2的体积分数不变
(2)若2 min时反应达平衡,此时气体质量增加8 g,则用H2表示该反应的反应速率为___________。
(3)某温度下该反应达平衡状态,测得混合气体的平均相对分子质量为14,则该温度下的平衡常数K为_____________。
(4)若降低温度,K值减小,则反应的ΔH______0(填“>”或“<”)。
(5)若反应达平衡后,加入少量的H2,再次平衡后,H2O的体积分数___________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 同温同压下,相同体积的物质,其物质的量一定相等
B. 任何条件下,等物质的量的甲烷和一氧化碳所占有的体积一定相等
C. 1 L一氧化碳气体一定比1 L氧气的质量小
D. 相同条件下的一氧化碳气体和氮气,若体积相等,则质量一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100 mL 0.1 mol·L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1 mol·L-1 Ba(OH)2溶液。随着 Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示。则下列说法中正确的是( )
A.a点发生反应的离子方程式是:
Al3++2SO42-+2Ba2++3OH— = Al(OH)3↓+2BaSO4↓
B.b点消耗Ba(OH)2溶液体积为200mL
C.从a→b 、b→c点过程中发生反应的离子方程式依次为:NH4++OH-=NH3·H2O;Al(OH)3+OH-=AlO2-+2H2O
D.沉淀的质量:a点>c点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气(含CO、SO2和NO等)是城市空气污染源之一,治理的方法之一是在汽车的排气管上装一个“催化转化器”,它能使一氧化碳跟一氧化氮反应生成可参与大气生态循环的无毒气体,并促进二氧化硫的转化。
(1)汽车尾气中导致酸雨形成的主要物质是____ ____。
(2)写出在催化剂的作用下CO跟NO反应的化学方程式:_______ ________。
(3)使用“催化转化器”的缺点是在一定程度上提高了排放废气的酸度,有可能促进了酸雨的形成,其原因是 。
(4)下列各项措施中,有利于缓解城市空气污染的有________(填序号)。
A.充分利用太阳能,减少能源消耗
B.使用电动车辆,减少汽油消耗
C.植树种草,绿化环境
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com