
【题目】下列叙述正确的是( )
A. 同温同压下,相同体积的物质,其物质的量一定相等
B. 任何条件下,等物质的量的甲烷和一氧化碳所占有的体积一定相等
C. 1 L一氧化碳气体一定比1 L氧气的质量小
D. 相同条件下的一氧化碳气体和氮气,若体积相等,则质量一定相等
科目:高中化学 来源: 题型:
【题目】工业上利用反应3Cl2+8NH3===N2+6NH4Cl检查氯气管道是否漏气。下列说法错误的是( )
A.若管道漏气遇氨就会产生白烟
B.该反应利用了Cl2的强氧化性
C.该反应中NH3被还原
D.该反应中氧化剂与还原剂的物质的量之比为3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在日常生活中出现了“加碘食盐”“增铁酱油”“高钙牛奶”“富硒茶叶”“含氟牙膏”等名词,这里的碘、铁、钙、硒、氟应理解为( )
A、元素 B、单质 C、分子 D、氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
I.已知:NO2(g)+SO2(g) ![]() SO3(g)+NO(g)
SO3(g)+NO(g)
(1)一定条件下,将NO2与SO2以体积比1:2置于恒容密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO2和NO2的体积比保持不变 d.每消耗1 mol SO3的同时生成1 molNO2
e.气体密度保持不变
(2)若保持体积不变,升高温度,体系颜色加深,则说明该反应的H________0(填”>””<”或”=”)
II.对于反应2SO2(g)+O2(g)![]() 2SO3(g);ΔH=-196.6kJ/mol。
2SO3(g);ΔH=-196.6kJ/mol。
在一定温度下,向一个容积不变的容器中,通入3mol SO2和2mol O2及固体催化剂,使之反应。平衡时容器内气体压强为起始时的90%。此时
(3)加入3mol SO2和2mol O2发生反应,达到平衡时,放出的热量为 。
(4)保持同一温度,在相同的容器中,将起始物质的量改为amol SO2、bmol O2、cmol SO3(g)及固体催化剂,欲使起始时反应表现为向正反应方向进行,且平衡时SO3的体积分数为2/9,a的取值范围是 。
(5)保持同一温度,在相同容器中,将起始物质的量改为3mol SO2、6mol O2、3mol SO3(g)及固体催化剂,则平衡_________移动。(填“正向、不、逆向或无法确定是否”)
(6)某SO2(g)和O2(g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图2所示,若不改变SO2(g)和O2(g)的量,则图中t4时引起平衡移动的条件可能是__________;图中表示平衡混合物中SO3的含量最高的一段时间是____________。
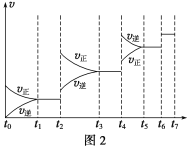
(7)各阶段平衡时对应的平衡常数如下表所示:
t1~t2 | t3~t4 | t5~t6 | t6~t7 |
K1 | K2 | K3 | K4 |
K1、K2、K3、K4之间的关系为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA是阿伏加德罗常数的值,下列说法正确的是
A.7g分子式为CnH2n的链烃中含有的C—H键的数目为NA
B.标准状况下,2.24 L CHCl3分子中共价键的数目为0.4NA
C.一定温度下,l L l mol·L-1的CH3COONa溶液含NA个CH3COO—离子
D.1 mol SO2与足量O2在一定条件下反应生成SO3的数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,在一定温度下可发生下列反应:
2N2O5(g)![]() 4NO2(g)+O2(g) ΔH>0 T1温度下的部分实验数据为:
4NO2(g)+O2(g) ΔH>0 T1温度下的部分实验数据为:
t/s | 0 | 500 | 1 000 | 1 500 |
c(N2O5)/(mol·L-1) | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法不正确的是( )
A.500 s内N2O5分解速率为2.96×10-3mol·L-1·s-1
B.T1温度下的平衡常数为K1=125,1 000 s时转化率为50%
C.其他条件不变,T2温度下反应到1000s时测得N2O5(g)浓度为2.98 mol·L-1,则T1<T2
D.T1温度下的平衡常数为K1,T3温度下的平衡常数为K3,若K1>K3,则T1>T3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数,下列说法正确的是
A. 标准状况下,22.4L乙醇所含的分子数必定为NA
B. 1 mol NO2与足量的水反应,转移的电子数为2NA
C. 0.1molFe粉与足量水蒸气反应生成的H2分子数为0.15NA
D. 在常温常压下32g氧气所含的原子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关性质的比较,不能用元素周期律解释的是( )
A. 酸性:H2SO4>H3PO4 B. 非金属性:Cl>Br
C. 碱性:NaOH>Mg(OH)2 D. 热稳定性:Na2CO3>NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)I.短周期元素X、Y、Z在元素周期表中的位置如下图所示,其中Y元素原子的最外层电子数是电子层数的两倍。回答下列问题:
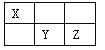
(1)Y元素在元素周期表中的位置是 。
(2)列举一个事实证明Y元素与Z元素的非金属性强弱: 。
(3)X的气态氢化物与其最高价氧化物对应的水化物反应生成盐。该盐溶液的pH 7(填“<”、“>”或“=”),其原因为(用离子方程式表示) 。
(4)X元素的某种液态氢化物,分子中含有18个电子,只存在共价单键。该物质在碱性溶液中能够将CuO还原为Cu2O,同时生成一种参与大气循环的气体。该反应的化学方程式为 。
II.已知可逆反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),平衡常数见下表:
CO2(g)+H2(g),平衡常数见下表:
温度/℃ | 500 | 700 | 850 | 1 000 |
平衡常数 | 2.5 | 1.7 | 1.0 | 0.6 |
(5)该反应ΔH 0(填“<”或“>”)。
(6)850 ℃时,若向一容积固定的密闭容器中同时充入1.0 mol CO、3.0 mol H2O、1.0 molCO2和x mol H2,若要使上述反应开始时正向进行,则x应满足的条件是 。
若x=5.0,当反应达到平衡时,n(H2)= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com