
【题目】下列离子方程式正确的是
A. 过氧化钠投入到水中:2Na2O2+2H2O=4Na++4OH-+ O2↑
B. 氯化铵溶液与浓NaOH 溶液加热:NH4++OH-=NH3·H2O
C. 氯化铝溶液中滴入过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3 NH4+
D. 实验室制取氯气:MnO2+4HCl![]() Mn2++Cl2↑+2Cl-+2H2O
Mn2++Cl2↑+2Cl-+2H2O
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
【题目】欲探究某矿石可能是由FeCO3、SiO2、Al2O3中的一种或几种组成,探究过程如图所示.已知:碳酸不能溶解Al(OH)3沉淀.
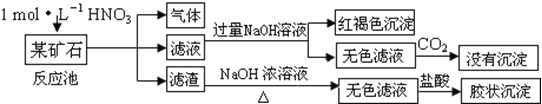
(1)Si在周期表中的位置是 .
(2)下列说法正确的是 .
a.酸性:H2CO3>H2SiO3b.原子半径:O<C<Si<Al
c.稳定性:H2O>CH4>SiH4d.离子半径:O2﹣<Al3+
(3)该矿石的组成是 ,滤渣和NaOH溶液反应的离子方程式是 .
(4)该矿石和1mol/LHNO3反应的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用反应3Cl2+8NH3===N2+6NH4Cl检查氯气管道是否漏气。下列说法错误的是( )
A.若管道漏气遇氨就会产生白烟
B.该反应利用了Cl2的强氧化性
C.该反应中NH3被还原
D.该反应中氧化剂与还原剂的物质的量之比为3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)水的电离平衡曲线如右图所示,若A点表示25 ℃时水的电离达平衡时的离子浓度,B点表示100 ℃时水的电离达平衡时的离子浓度。则100 ℃时1 mol·L-1的NaOH溶液中,由水电离出的c(H+)=________mol·L-1,KW(25 ℃)________KW(100 ℃)(填“>”、“<”或“=”)。

(2)25 ℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是________(填“促进”、“抑制”或“不影响”)。
已知如表数据。
化学式 | 电离平衡常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7 K2=5.6×10-11 |
(3)25 ℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为____ ___。(填化学式)
(4)25 ℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,所得溶液显碱性,则c(Na+)________c(CH3COO-)(填“>”、“<”或“=”)。
(5)向NaCN溶液中通入少量CO2,反应的化学方程式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 用胆矾炼铜、烧结粘土制陶瓷都涉及化学变化
B. 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈
C. 食盐、醋酸、氨水和硫酸钡都是电解质
D. 胶体区别其它分散系的本质特征是分散质微粒直径在1nm~100nm之间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】综合利用海水可以制备食盐、纯碱、金属镁等钩质,其流程示意图如下:
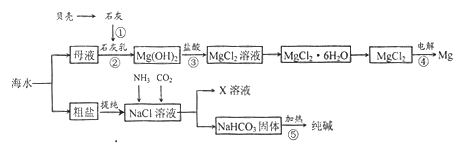
(1)在上述反应①~⑤中,没有涉及的化学反应类型是______。
A.分解反应 B.化合反应
C.复分解反应 D.置换反应
(2)写出反应③的离子方程式______________。
(3)粗盐中含有Na2SO4、MgCl2、CaCl2等可溶性杂质,为制得纯净的NaCl晶体,操作如下:
①溶解;
②依次加入过量的BaCl2溶液、NaOH溶液、_____________;
③过滤;
④______________;
⑤蒸发结晶。
其中加入过量氯化钡溶液的目的是____________________。
(4)X溶液中的主要阳离子是Na+和________________。
(5)检验纯碱样品中是否含NaCl应选用的试剂是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在日常生活中出现了“加碘食盐”“增铁酱油”“高钙牛奶”“富硒茶叶”“含氟牙膏”等名词,这里的碘、铁、钙、硒、氟应理解为( )
A、元素 B、单质 C、分子 D、氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
I.已知:NO2(g)+SO2(g) ![]() SO3(g)+NO(g)
SO3(g)+NO(g)
(1)一定条件下,将NO2与SO2以体积比1:2置于恒容密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO2和NO2的体积比保持不变 d.每消耗1 mol SO3的同时生成1 molNO2
e.气体密度保持不变
(2)若保持体积不变,升高温度,体系颜色加深,则说明该反应的H________0(填”>””<”或”=”)
II.对于反应2SO2(g)+O2(g)![]() 2SO3(g);ΔH=-196.6kJ/mol。
2SO3(g);ΔH=-196.6kJ/mol。
在一定温度下,向一个容积不变的容器中,通入3mol SO2和2mol O2及固体催化剂,使之反应。平衡时容器内气体压强为起始时的90%。此时
(3)加入3mol SO2和2mol O2发生反应,达到平衡时,放出的热量为 。
(4)保持同一温度,在相同的容器中,将起始物质的量改为amol SO2、bmol O2、cmol SO3(g)及固体催化剂,欲使起始时反应表现为向正反应方向进行,且平衡时SO3的体积分数为2/9,a的取值范围是 。
(5)保持同一温度,在相同容器中,将起始物质的量改为3mol SO2、6mol O2、3mol SO3(g)及固体催化剂,则平衡_________移动。(填“正向、不、逆向或无法确定是否”)
(6)某SO2(g)和O2(g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图2所示,若不改变SO2(g)和O2(g)的量,则图中t4时引起平衡移动的条件可能是__________;图中表示平衡混合物中SO3的含量最高的一段时间是____________。
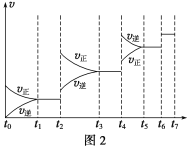
(7)各阶段平衡时对应的平衡常数如下表所示:
t1~t2 | t3~t4 | t5~t6 | t6~t7 |
K1 | K2 | K3 | K4 |
K1、K2、K3、K4之间的关系为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关性质的比较,不能用元素周期律解释的是( )
A. 酸性:H2SO4>H3PO4 B. 非金属性:Cl>Br
C. 碱性:NaOH>Mg(OH)2 D. 热稳定性:Na2CO3>NaHCO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com