
【题目】综合利用海水可以制备食盐、纯碱、金属镁等钩质,其流程示意图如下:
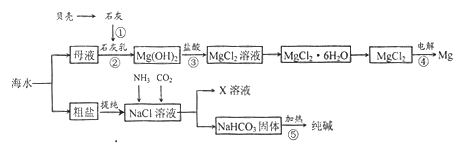
(1)在上述反应①~⑤中,没有涉及的化学反应类型是______。
A.分解反应 B.化合反应
C.复分解反应 D.置换反应
(2)写出反应③的离子方程式______________。
(3)粗盐中含有Na2SO4、MgCl2、CaCl2等可溶性杂质,为制得纯净的NaCl晶体,操作如下:
①溶解;
②依次加入过量的BaCl2溶液、NaOH溶液、_____________;
③过滤;
④______________;
⑤蒸发结晶。
其中加入过量氯化钡溶液的目的是____________________。
(4)X溶液中的主要阳离子是Na+和________________。
(5)检验纯碱样品中是否含NaCl应选用的试剂是______________。
【答案】 D Mg(OH)2+2H+=Mg2++2H2O Na2CO3溶液 在滤液中加适量盐酸调节溶液pH至7 使溶液中SO42-转化为沉淀而除去 NH4+ AgNO3溶液、稀硝酸
【解析】试题分析:(1)反应①是化合反应,②③属于复分解反应,属于化合反应,④属于分解反应、氧化还原反应,⑤分解反应;(2)酸碱中和反应,Mg (OH)2不溶于水写成化学式;(3)BaCl2溶液与Na2SO4反应生成硫酸钡沉淀;NaOH溶液与MgCl2反应生成氢氧化镁沉淀;CaCl2与Na2CO3溶液反应生成碳酸钙沉淀;过滤后的溶液含有氢氧化钠和碳酸钠杂质,除去沉淀后再加盐酸除去氢氧化钠和碳酸钠,然后通过蒸发结晶得到氯化钠晶体;氯化钠、氨气、二氧化碳、水反应生成碳酸氢钠沉淀和氯化铵;(5)检验纯碱样品中是否含NaCl,即检验是否存在氯离子;
解析:(1)在上述反应CaO+H2O=Ca(OH)2属于化合反应、MgCl2+ Ca(OH)2=Mg(OH)2+CaCl2属于复分解反应、Mg(OH)2+2HCl=MgCl2+2H2O属于复分解反应、MgCl2=Mg+Cl2属于分解反应、2NaHCO3=Na2CO3+CO2+H2O属于分解反应,没有涉及的化学反应类型是置换反应;(2)Mg (OH)2不溶于水写成化学式③的离子方程式为Mg(OH)2+2H+=Mg2++2H2O;(3)CaCl2与Na2CO3溶液反应生成碳酸钙沉淀,加入碳酸钠溶液除去氯化钙;④过滤后的溶液含有氢氧化钠和碳酸钠杂质,除去沉淀后加盐酸除去氢氧化钠和碳酸钠;加入BaCl2溶液目的是与Na2SO4反应生成硫酸钡沉淀,除去Na2SO4;(4)氯化钠、氨气、二氧化碳、水反应生成碳酸氢钠沉淀和氯化铵,X溶液中的主要阳离子是Na+和NH4+;检验纯碱样品中是否含NaCl的方法是,将纯碱样品溶于水,滴入AgNO3溶液、稀硝酸,若产生白色沉淀则含有NaCl。


科目:高中化学 来源: 题型:
【题目】下列电离方程式,书写正确的是( )
A. Al2(SO4)3=2Al3++ 3SO42- B. AlCl3= Al3++Cl-
C. Mg(NO3)2= Mg+2+2NO3- D. KMnO4=K++Mn7++4O2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s) + 4CO(g)![]() Ni(CO)4(g),已知该反应平衡常数与温度的关系如下表。
Ni(CO)4(g),已知该反应平衡常数与温度的关系如下表。
下列说法正确的是( )
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10-5 |
A. 上述生成Ni(CO)4(g)的反应为吸热反应
B. 25℃时反应Ni(CO)4(g)![]() Ni(s) + 4CO(g)的平衡常数为0.5
Ni(s) + 4CO(g)的平衡常数为0.5
C. 在某条件下达到平衡,测得Ni(CO)4、CO浓度均为0.5mol·L-1,则此时温度高于80℃
D. 80℃达到平衡时,保持体积不变,往体系中充入一定量的CO,再次达到平衡后CO的体积分数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.能电离出氢离子的化合物叫做酸
B.能电离出氢氧根离子的化合物叫做碱
C.能电离出酸根离子的化合物叫做盐
D.由金属离子和酸根离子组成的化合物属于盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 过氧化钠投入到水中:2Na2O2+2H2O=4Na++4OH-+ O2↑
B. 氯化铵溶液与浓NaOH 溶液加热:NH4++OH-=NH3·H2O
C. 氯化铝溶液中滴入过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3 NH4+
D. 实验室制取氯气:MnO2+4HCl![]() Mn2++Cl2↑+2Cl-+2H2O
Mn2++Cl2↑+2Cl-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH3COOH为常见的弱酸,在工业生产和生活中有广泛的应用。
I.(1)常温下中和100 mL pH=3的CH3COOH溶液和1 L pH=4的CH3COOH溶液,需要等物质的量浓度的NaOH溶液的体积分别为V1和V2,则V1_______V2(填“>”、“=”或“<”)。
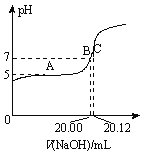
(2)常温下,用0.1000 mol/L的NaOH溶液滴定20.00 mL某未知浓度的CH3COOH溶液,滴定曲线如图所示。其中A点所示溶液中c(CH3COO-)=2c(CH3COOH),C点所示溶液中存在c(CH3COO-)+c(CH3COOH)=c(Na+)。则常温下CH3COOH的电离常数Ka=_________,CH3COOH溶液的实际浓度为____________。
Ⅱ.1100℃时,体积为2 L的恒容容器中发生如下反应:
Na2SO4(s)+4H2(g)![]() Na2S(s)+4H2O(g)。
Na2S(s)+4H2O(g)。
(1)下列能判断反应达到平衡状态的是________。
A.容器中压强不变
B.混合气体密度不变
C.1 mol H-H键断裂同时形成2 mol H-O
D.H2的体积分数不变
(2)若2 min时反应达平衡,此时气体质量增加8 g,则用H2表示该反应的反应速率为___________。
(3)某温度下该反应达平衡状态,测得混合气体的平均相对分子质量为14,则该温度下的平衡常数K为_____________。
(4)若降低温度,K值减小,则反应的ΔH______0(填“>”或“<”)。
(5)若反应达平衡后,加入少量的H2,再次平衡后,H2O的体积分数___________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不能由醛或酮加氢还原制得的醇是( )
A. CH3CH2OH B. CH3CH2CH(OH)CH3
C. (CH3)3CCH2OH D. (CH3)3COH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com