
【题目】某强酸性的透明溶液中可能含有下列微粒中的几种。
阴离子:MnO4-、SiO32-、CO32-、I-、ClO-、SO32-
阳离子:Fe3+、Fe2+、NH4+、Ag+、Al3+、K+
分子: H2SO3
取该溶液进行以下连续实验。
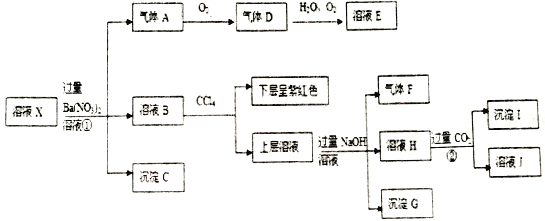
根据以上信息,回答下列问题:
(1)根据“强酸性的透明溶液”可知溶液中不含有的微粒是__________________;
(2)沉淀I的化学式为_____________;
(3)X溶液中,除H+、Al3+外还肯定含有的微粒是_____________。
【答案】 SiO32-、CO32-、ClO-、SO32- Al(OH)3 I-、NH4+、Fe2+、H2SO3
【解析】根据强酸性溶液,排除与氢离子不能大量共存的离子以及在酸性溶液中会发生氧化还原反应的离子。结合图中的有关转化和物质的性质分析解答。
(1)根据“强酸性的透明溶液”可知溶液中不含有的微粒是能与氢离子反应的离子,即弱酸的酸根离子:SiO32-、CO32-、ClO-、SO32-;(2)加入过量硝酸钡生成沉淀,则该沉淀为BaSO4沉淀,说明溶液中含有亚硫酸分子,则一定不存在MnO4-、Fe3+;生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,为Fe2+离子或碘离子,溶液B中加入四氯化碳,下层呈紫红色,说明有碘生成,即一定存在碘离子,所以不存在银离子。上层溶液中加入过量NaOH溶液,生成气体F,则F为NH3,说明溶液中含有铵根离子,溶液H中溶于CO2气体,生成沉淀I,则I为氢氧化铝,H为NaOH和NaAlO2,说明溶液中含有Al3+离子;沉淀G是氢氧化铁,即溶液中一定存在亚铁离子。(3)根据以上分析可知X溶液中,除H+、Al3+外还肯定含有的微粒是I-、NH4+、Fe2+、H2SO3。


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】现有中学化学常见三种金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,其中B是地壳中含量最多的金属。它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。

请根据以上信息回答下列问题:
(1)写出下列物质的化学式:乙______________、H______________。
(2)写出反应⑤的离子方程式:__________________________________________。
(3)D溶液与F溶液反应,生成沉淀,该沉淀的化学式为_____________,该沉淀在空气中由白色很快变为灰绿色最后变为红褐色,该反应的化学方程式为______________。
(4)物质C与物质E的溶液反应生成5.6 L氢气(标准状况)时,参与反应的物质C的质量是_______克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是制取氢气的常用原料,下列有关水的说法不正确的是
A. 水分子是一种极性分子,空间结构呈三角锥形
B. H2O分子中有2个由s轨道与sp3杂化轨道形成的σ键
C. H2O和H+以配位键结合并形成H3O+
D. 水在固态时形成的晶体为分了晶体,存在氢键和分子间作用力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.实验室需要0.1mol/L盐酸溶液490mL,现进行配制,请在横线上填写适当的仪器名称,操作方法或数字。
(1)用量筒量取密度为1.19g/cm3质量分数为36.5%的浓盐酸_______mL注入烧杯中。
(2)在盛盐酸的烧杯中注入少量蒸馏水,用玻璃棒搅拌,使其混匀。
(3)待稀释的盐酸冷却后,沿玻璃棒注入______中。
(4)用蒸馏水洗涤烧杯、玻璃棒2~3次,将洗涤液注入容量瓶中。
(5)往容量瓶中小心加蒸馏水至液面接近刻度线______cm处,改用______滴加蒸馏水,使溶液凹液面的最低处恰好与刻度线相切。
Ⅱ.若实验遇到下列情况,对所配氢氧化钠溶液的物质的量浓度有何影响(填偏高、偏低、无影响)。
(1)未将洗涤液加入容量瓶______
(2)配制前容量瓶用水洗涤后未进行干燥处理_______;
(3)氢氧化钠溶液未冷却至室温就转移到容量瓶_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA是阿伏加德罗常数的值,下列说法正确的是
A.7g分子式为CnH2n的链烃中含有的C—H键的数目为NA
B.标准状况下,2.24 L CHCl3分子中共价键的数目为0.4NA
C.一定温度下,l L l mol·L-1的CH3COONa溶液含NA个CH3COO—离子
D.1 mol SO2与足量O2在一定条件下反应生成SO3的数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式是( )
A.金属铝溶于稀硫酸中:Al+2H+===Al3++H2↑
B.碳酸锌溶于稀硝酸中:CO+2H+===H2O+CO2↑
C.醋酸钠水溶液中通入足量CO2: 2CH3COO-+CO2+H2O===2CH3COOH+CO
D.H2SO4与Ba(OH)2溶液反应: Ba2++2OH-+2H++SO===BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生研究小组欲探究CuSO4溶液与Na2CO3溶液混合产生的蓝绿色沉淀组成,小组进行下列实验探究。
【提出假设】
假设1:沉淀为Cu(OH)2;
假设2:所得沉淀为_ ;
假设3:所得沉淀为碱式碳酸铜[化学式可表示为nCu(OH)2·mCuCO3]。
【查阅资料】无论是哪一种沉淀受热均易分解(假设均不含结晶水)。
【物质成分探究】
步骤1:将所得悬浊液过滤,用蒸馏水洗涤,再用无水乙醇洗涤;
步骤2:甲同学取一定量所得固体,用气密性良好的如图装置(夹持仪器未画出)进行定性实验。[
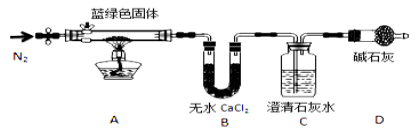
请回答下列问题:
(1)假设2中的沉淀是为 。
(2)假设1中沉淀为Cu(OH)2的理论依据是 。
(3)无水乙醇洗涤的目的 。
(4)若反应后A中蓝绿色固体变黑,C中无明显现象,证明假设__________(填写序号)成立。
(5)乙同学认为只要将上图中B装置的试剂改用___________试剂后,便可验证上述所有假设。
(6)乙同学更换B试剂后验证假设3成立的实验现象是_____ ____。
(7)在假设3成立的前提下,某同学考虑用Ba(OH)2代替Ca(OH)2,测定蓝绿色固体的化学式,若所取蓝绿色固体质量为27.1g,实验结束后装置B的质量增加2.7g,C中的产生沉淀的质量为19.7g。则该蓝绿色固体的化学式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com